Médicaments : d’où viennent les pénuries ?

Avant-propos
Depuis plusieurs années, les patients français rencontrent épisodiquement des difficultés pour obtenir le médicament qui leur a été prescrit. On se souvient notamment de la raréfaction de l’amoxicilline pédiatrique dans les officines durant les hivers 2022 et 2023. Citons aussi les alertes répétées des psychiatres depuis le printemps 2025 sur le risque qu’encourent de nombreux patients qui n’ont pas accès à des psychotropes. Systématiquement, une seule et même cause est avancée pour expliquer ces pénuries : la délocalisation de la production, notamment en Asie. Il faut dire que l’incapacité de la France à distribuer des masques à sa population dans les premiers jours de la pandémie de Covid ou, plus tard, ses difficultés à s’approvisionner en paracétamol parce que la Chine connaissait un rebond épidémique, ont marqué au fer rouge l’opinion publique en ce sens.
Suffirait-il donc d’une relocalisation de la production en France et en Europe pour endiguer ce phénomène ? Le travail d’enquête mené par les auteurs de cet ouvrage apporte une réponse nuancée à cette question. En recherchant les causes racines de ces pénuries, ils montrent en effet que les délocalisations sont moins problématiques que la très forte concentration des acteurs sur chaque maillon de la chaîne de production. Appeler à une relocalisation européenne n’a donc d’intérêt que si celle-ci permet de multiplier le nombre de fournisseurs à chaque étape de la fabrication. En France, plus spécifiquement, cette relocalisation de la production pourrait en outre ne pas suffire à corriger le déséquilibre entre offre et demande, si ne sont pas revues dans le même temps certaines pratiques de nature à fragiliser l’offre d’un côté et à augmenter la demande de l’autre. C’est pourquoi les auteurs de cet ouvrage apportent quelques pistes complémentaires aux différentes mesures déjà prises par le gouvernement pour répondre aux failles identifiées.
Nous espérons que ce Doc offrira aux décideurs publics, aux industriels, aux professionnels du secteur de la santé comme aux patients, des pistes pour tenter de juguler collectivement ce problème de santé publique.
L’équipe de La Fabrique
En Résumé
L’approvisionnement de la France en produits de santé – médicaments et dispositifs médicaux (DM) – est un sujet qui a pris le devant de la scène médiatique et politique ces dernières années. Et pour cause : le nombre de déclarations de ruptures de stock de médicaments a triplé entre 2014 et 2023 en France1. En outre, la grande majorité de ces pénuries concerne les molécules les plus matures. Diverses initiatives et plusieurs rapports ont été élaborés pour endiguer ce problème, mais, malgré une légère résorption des pénuries depuis fin 2024, la situation reste bien plus critique qu’elle ne l’était au début des années 2010.
L’enquête de terrain menée auprès d’industriels, de professionnels de santé, de représentants de l’administration et de patients révèle en première instance que les ruptures sont directement liées au manque de redondance dans la chaîne d’approvisionnement : chaque maillon de la chaîne est représenté par un nombre trop limité d’acteurs – quand ils sont plusieurs – avec des capacités de production limitées. Mais cette première analyse dissimule en réalité des causes racines plus profondes et multifactorielles.
Côté offre, plusieurs facteurs sont de nature à freiner le développement de la concurrence sur la chaîne de production européenne. On peut citer des exigences environnementales plus importantes en Europe qu’en Asie qui, considérant la recherche d’économies d’échelle et de réduction des coûts des industriels, ne sont pas de nature à favoriser la redondance le long de la chaîne de production. À cela s’ajoutent des mécanismes d’administration des prix présents dans plusieurs pays européens, et spécifiquement en France les systèmes d’appels d’offres pour les achats hospitaliers (60 % du marché français des produits de santé) qui ne favorisent pas l’augmentation des capacités de production, en particulier pour les produits les plus anciens. Ces différents facteurs conduisent à un déséquilibre parfois durable entre l’offre et la demande, aggravé par le fait qu’en France la demande en produits de santé est supérieure aux besoins réels.
À ce jour, les travaux menés sur les pénuries de produits de santé ont souvent proposé des mesures palliatives, dont la mise en place de stocks obligatoires pour plus de la moitié des médicaments ou encore la confection de plusieurs listes de produits critiques. Bien qu’utiles dans une certaine mesure, ces propositions ne tiennent pas toujours compte de la diversité et de certaines spécificités des produits de santé. Face à des pénuries aux causes multiples, la réponse ne peut être que plurielle. Elle doit en outre s’établir sur la base d’une étude médico-économique visant à estimer le coût de gestion des pénuries en France. Cette démarche initiale permettra de légitimer les investissements et la mise en place de mesures fortes – et parfois coûteuses – nécessaires à l’éradication d’un phénomène qui s’est enraciné. Des mesures qui devront conduire au renforcement de la redondance des capacités de production de produits arrivés à maturité, et au soutien d’une industrie pharmaceutique européenne durable, tout le long de la chaîne de production. Ces deux piliers d’une consolidation de l’offre devront toutefois s’accompagner d’une rationalisation de la consommation française et d’une amélioration du parcours du patient dans un contexte de pénuries.
- 1 – Selon l’Agence nationale de sécurité du médicament (ANSM), le nombre de déclarations de pénurie de médicaments, qui comprennent à la fois les ruptures et les risques de rupture de stock, a été multiplié par près de neuf entre 2014 et 2024, avec une aggravation durable du phénomène à partir de 2019.
Remerciements
Ce livre est issu d’un mémoire de dernière année été pour nous une opportunité unique de nous plonger dans le sujet passionnant des pénuries de produits de santé.
Nous tenons à vivement remercier Frédéric Kletz, professeur à l’École des mines de Paris, pour son accompagnement tout au long de ce projet. Sa connaissance du domaine hospitalier a été particulièrement utile pour mieux différencier les défis liés aux pénuries en ville de ceux rencontrés à l’hôpital.
Nous souhaitons chaleureusement remercier le Dr Grégory Emery, directeur général de la santé (DGS) puis conseiller santé, handicap, personnes âgées à l’Élysée, qui a accepté de nous suivre dans le cadre de ce projet. Le partage de son expertise et ses retours constructifs ont été d’une aide précieuse.
Les conseils avisés et le soutien apporté par Pierre Pribile, directeur de la sécurité sociale (DSS), de Bernard Celli, vice-président du Comité économique des produits de santé (CEPS), et de Agnès Audier, senior advisor au sein du Boston Consulting Group, ont par ailleurs été déterminants dans la rédaction de cet ouvrage. Nous leur sommes particulièrement reconnaissants du temps qu’ils nous ont accordé.
Enfin, plus généralement, nous tenons à remercier l’ensemble des personnes rencontrées dans le cadre de ce travail : industriels, représentants d’administration, médecins, pharmaciens, syndicats ou encore associations de patients. Les échanges ont tous été enrichissants, et nous avons grandement apprécié la transparence avec laquelle l’ensemble des acteurs a partagé son vécu et son analyse des pénuries de produits de santé. L’engagement de chacun des acteurs face aux pénuries a marqué l’ensemble des entretiens réalisés.
Introduction
Les pénuries de produits de santé (médicaments et dispositifs médicaux) sont désormais un sujet majeur de santé publique. Selon les chiffres de l’Agence nationale de sécurité du médicament et des produits de santé (ANSM), le nombre de déclarations de rupture de stock de médicaments a triplé entre 2014 et 2023 en France2. Le nombre de tensions d’approvisionnement a en outre fortement augmenté durant cette période – avec une aggravation rapide de la situation entre 2019 et 20213. Cela n’est pas sans conséquence pour les patients : en 2023, 37 % des patients français ont été concernés par les pénuries de médicaments (de La Provôté et Cohen, 2023) et 45 % des personnes touchées ont dû modifier leur traitement ou y renoncer, avec parfois des conséquences dramatiques (France Assos Santé, 2023). Ce sujet n’est toutefois pas une spécificité française : l’ensemble des pays européens et les États-Unis y sont également confrontés (PGEU, 2024 ; Daniel McGeeney, 2025). Pour prévenir les pénuries, l’Union européenne (UE) a d’ailleurs créé en 2024 l’Alliance des médicaments critiques, chargée notamment de définir une politique industrielle pour améliorer la sécurité de l’approvisionnement, renforcer la disponibilité des médicaments et réduire les dépendances de la chaîne d’approvisionnement européenne.
Du côté des dispositifs médicaux, qui rassemblent aussi bien les masques chirurgicaux que les prothèses ou les stimulateurs cardiaques, les pénuries sont tout aussi sensibles. Si le manque de masques chirurgicaux lors de la pandémie de Covid-19 est devenu un exemple emblématique, ce n’est que l’arbre qui cache la forêt. Entre 2021 et 2024, une centaine de dispositifs médicaux ont été signalés en pénurie auprès de l’ANSM, affectant de nombreux patients, notamment à l’hôpital.
Pour préparer cet ouvrage, nous avons interrogé une cinquantaine de personnes (industriels, représentants de l’administration, professionnels de santé, patients) et tenté de comprendre d’où venaient ces pénuries. Ces personnalités nous ont permis de mieux appréhender la spécificité du marché des produits de santé ; c’est tout l’objet du premier chapitre de ce livre. La puissance publique a déjà beaucoup œuvré pour mettre fin aux pénuries et tensions d’approvisionnement, mais nous verrons dans le deuxième chapitre que, malgré une légère résorption des pénuries depuis fin 2024, la situation reste bien plus critique qu’elle ne l’était au début des années 2010. Le chapitre 3 examine donc les causes profondes de ces pénuries, sur la base desquelles nous expliquons dans un dernier chapitre pourquoi aucune des mesures mises en place n’a encore permis d’y répondre pleinement. Forts de cette analyse, nous présentons également quelques propositions opérationnelles pour rééquilibrer l’offre et la demande en produits de santé.
- 2 – L’ANSM a développé data.ansm, un outil en ligne permettant d’accéder aux déclarations de rupture de stock et d’effets indésirables.
- 3 – Source : ministère du Travail, de la Santé, des Solidarités et des Familles, 2025.
Le produit de santé : un bien de consommation pas comme les autres
Bien qu’il comprenne des fabricants, des distributeurs et des consommateurs, comme n’importe quel autre marché, celui des médicaments et des dispositifs médicaux se distingue par une très forte réglementation et un contrôle permanent. En France, cette réglementation se double d’une administration des prix qui cherche à garantir un accès de tous aux médicaments sans trop alourdir les dépenses publiques de santé.
Le marché très encadré des médicaments et des dispositifs médicaux
L’arborescence des médicaments : des principes actifs aux présentations
Les produits de santé recouvrent à la fois les produits pharmaceutiques (médicaments à usage humain, médicaments vétérinaires, produits réglementés tels que les cosmétiques ou les produits de tatouage) et les dispositifs médicaux.
En pratique, le médicament peut, d’une part, être issu de la chimie : il peut s’agir, entre autres, d’un antibiotique (comme la pénicilline), d’un inhibiteur de la réplication virale ou d’un anticancéreux. Le médicament peut, d’autre part, être issu du vivant : on parle dans ce cas de « biothérapie » ou de médicament « bioproduit » (on parle de médicament biologique). Il s’agit par exemple d’anticorps monoclonaux ou de thérapies cellulaires (comme les cellules CAR-T utilisées dans le traitement de certains cancers4 ).
Dans tous les cas, le médicament se compose d’un principe actif, dit API (de l’anglais Active Pharmaceutical Ingredient ), et d’excipients qui entrent en composition dans sa formulation. L’API est la molécule active d’un point de vue biologique. En complément, les excipients visent à donner à l’API une forme galénique stable (c’est-à-dire, la façon de fabriquer le médicament : comprimé simple, enrobé, gélule, ampoule, etc.) ou à améliorer ses propriétés organoleptiques (sucrosité, diminution de l’amertume).
La dénomination commune internationale (DCI) d’un médicament est le nom standardisé de l’API qui le compose, comme le paracétamol, l’amoxicilline et l’ibuprofène. Un médecin prescrit généralement une DCI, à une posologie donnée, avec un mode d’administration (oral, cutané, par exemple).
Une spécialité pharmaceutique correspond à une marque commerciale. Le nom de la marque peut contenir la DCI du médicament, notamment dans le cas des médicaments génériques. Par exemple, Doliprane®, Dafalgan® et Paracétamol Viatris® sont trois spécialités d’une même DCI, le paracétamol.
Enfin, la présentation d’une spécialité pharmaceutique correspond à la « [forme] d’emploi d’un médicament, telle qu’elle est délivrée à l’acheteur par l’officine pharmaceutique »5 . C’est donc la combinaison unique d’une spécialité, d’un dosage, d’une forme pharmaceutique (comprimé, gélule, etc.) et d’un conditionnement. Par exemple, le Doliprane® 500 mg effervescent à 16 comprimés correspond à une présentation. En France, la Direction de la recherche, des études, de l’évaluation et des statistiques du ministère de la Santé en dénombre près de 13 000 (Drees, 2022).
Chaque présentation fait l’objet de plusieurs lots de production, chacun associé à un numéro de lot et à une date d’expiration. Quand une présentation fait défaut, il est possible de chercher une autre présentation de la même spécialité avec une autre dose ou forme : si le Doliprane® 500 mg effervescent à 16 comprimés est introuvable, la présentation 500 mg en sachet est peut-être disponible. Toutefois, il est possible que toute une gamme de présentations d’une même spécialité fasse défaut : le Doliprane 500 mg est alors en rupture. Pire encore : si les marques concurrentes comme Dafalgan® ou Paracétamol Viatris® sont également en rupture (toutes présentations confondues), alors c’est toute la DCI qui est concernée par une pénurie. C’est pourquoi, pour évoquer le sujet des pénuries, nous mentionnerons principalement les DCI et les spécialités pharmaceutiques.
Le monde très hétérogène des dispositifs médicaux
Les dispositifs médicaux (DM) sont définis dans le Code de la santé publique comme « tout instrument, appareil, équipement, matière, produit, à l’exception des produits d’origine humaine, ou autre article utilisé seul ou en association, y compris les accessoires et logiciels nécessaires au bon fonctionnement de celui-ci, destiné par le fabricant à être utilisé chez l’homme à des fins médicales ». Un scanner, un masque chirurgical et une prothèse de hanche sont autant de dispositifs médicaux.
Les DM sont répartis en quatre grandes catégories, à l’initiative de leur fabricant, selon le niveau de criticité pour le patient et le professionnel de santé intervenant lors de son utilisation (voir encadré).
Par rapport au médicament, le DM se caractérise par plusieurs singularités, qui sont autant de facteurs aggravants des pénuries dont il peut faire l’objet.
Les DM comptent d’abord un nombre de références au moins 100 fois plus important que les médicaments6 .
Le gouvernement estime qu’il y aurait sur le marché entre 800 000 et 2 millions de DM différents. Cela rend de facto impossible un suivi systématique des flux. Pour autant, seul un comité bimensuel interministériel intégrant des retours du terrain permet de suivre la situation sur des exemples concrets de rupture constatée7 . Il n’y a pas eu, à notre connaissance, d’étude systématique des pénuries de DM mais seulement des agrégations de cas particuliers, rendant complexe toute tentative de diagnostic exhaustif. Les DM comprennent ensuite un nombre de composants plus important. Plusieurs entretiens nous ont confirmé qu’un dispositif médical contenait en moyenne plus de vingt composants, là où le médicament ne contient qu’un principe actif et quelques excipients. Cette multitude d’intrants constitue autant de vulnérabilités dans la chaîne de production, d’autant plus que, contrairement au médicament, leurs matières premières ne sont pas spécifiques à l’industrie de santé. Par exemple, certaines nuances d’acier utilisées pour la confection de dispositifs médicaux le sont aussi par la filière automobile. Il existe donc un risque de compétition interfilières pour l’approvisionnement en certains intrants. Enfin, le geste médical associé à la mise en place du produit est souvent prescripteur-dépendant (ou opérateur-dépendant), ce qui rend complexe la substitution d’une référence par une autre. Plusieurs entretiens confirment par exemple que la formation des chirurgiens à l’usage de certains outils peut aboutir à des monopoles de pratique au sein des hôpitaux.
Les classes de dispositifs médicaux
Les quatre classes de dispositifs médicaux sont définies dans le règlement européen Medical Device Regulation (MDR). Les fabricants doivent répondre aux exigences de la catégorie de leur produit pour obtenir le marquage CE, indispensable à la commercialisation au sein de l’UE.
La classe I comprend les DM les moins critiques, généralement non invasifs. Il s’agit, par exemple, des lunettes de vue ou des fauteuils roulants.
La classe IIa inclut les DM avec une criticité potentielle faible : lentilles de contact, prothèses auditives, etc. Les DM invasifs à usage temporaire (moins d’une heure) et de court terme (moins d’un mois) sont par défaut inclus dans cette catégorie. Cette catégorie compte également les DM dits actifs, c’est-à-dire alimentés par une source d’énergie non humaine, et en particulier les outils de diagnostic.
La classe IIb se distingue par une criticité plus élevée : elle inclut principalement les DM chirurgicaux invasifs à usage de plus long terme (plus d’un mois), et les DM implantables, destinés à rester dans le corps humain. Les pompes à perfusion en sont un exemple.
La classe III rassemble les DM les plus critiques qui, au-delà des caractéristiques de la catégorie IIb, touchent le système circulatoire ou nerveux, ou peuvent délivrer un médicament. Elle comprend également les prothèses (de hanche, mammaires, etc.).
Des produits très contrôlés par les agences du médicament
Pour mettre leurs produits sur le marché, les laboratoires doivent obtenir une autorisation. Dans le cas du médicament, c’est l’Agence nationale de sécurité du médicament (ANSM) ou l’Agence européenne du médicament (EMA) qui délivre cette autorisation de mise sur le marché (AMM). L’ANSM délivre les AMM pour les médicaments à l’échelle nationale sur la base des études cliniques.
Dans le cas du dispositif médical, un organisme notifié (ON) est habilité à délivrer le marquage CE. Il n’existe, à ce jour en France, que deux organismes notifiés français : l’Association française de normalisation (l’Afnor) et le Groupement pour l’évaluation des dispositifs médicaux (GMED).
La création d’une agence française du médicament remonte à 1993, en réaction à l’affaire dite du sang contaminé. Elle découle en particulier de la volonté de l’exécutif de doter le pays d’une capacité centralisée d’évaluation et de contrôle des produits de santé. L’Agence du médicament voit ses prérogatives élargies en 1999 : elle change de nom pour devenir l’Agence française de sécurité sanitaire des produits de santé (AFSSAPS), et intègre désormais un périmètre plus large que celui des seuls médicaments. Réformée à la suite du scandale du Mediator en 2012, l’AFSSAPS renaît sous sa forme actuelle : l’Agence nationale de sécurité du médicament (ANSM). Elle se dote alors d’une gouvernance intégrant un conseil scientifique, en sus de son conseil d’administration. Son périmètre n’évolue pas, mais l’objectif de cette dernière réforme est d’accroître la transparence envers les patients et les professionnels de santé, ainsi que la réactivité face aux situations de crise, et de limiter les conflits d’intérêts8 .
L’ANSM dispose aujourd’hui de compétences propres. En plus de délivrer les AMM, elle évalue en continu le rapport risque/bénéfice des produits de santé, et assure ainsi une mission de contrôle et de surveillance. Pour ce faire, elle dispose d’un pouvoir de contrôle (tests qualité au sein de ses laboratoires) et d’un pouvoir d’inspection de tous les maillons de la chaîne de production du médicament (industriel, distribution, etc.). Si son inspection révèle des manquements, l’ANSM dispose alors d’un pouvoir de sanction, par le biais d’injonctions ou de sanctions financières. Par exemple, en 2024, elle a prononcé 8 millions d’euros de sanctions financières à l’encontre de onze laboratoires pharmaceutiques pour non-respect des niveaux de stocks de sécurité définis par la loi. L’agence garantit par ailleurs la bonne information des usagers en communiquant auprès des patients et professionnels de santé9 et en encadrant la publicité relative aux produits de santé. Cette communication est possible par un travail de veille en continu. Enfin, en réaction à une situation de crise, l’ANSM dispose de pouvoirs propres. En cas de tension ou de rupture de stock d’un médicament, elle peut par exemple interdire l’exportation d’un médicament hors du territoire, imposer un contingentement qualitatif (quand l’accès au médicament est réservé à une certaine population de patients) ou quantitatif (le nombre de doses par patient est réduit). Elle peut aussi décider du retrait d’un produit du marché, par exemple, lorsqu’elle estime qu’il présente un danger.
L’Agence européenne des médicaments (EMA) a un rôle complémentaire. L’EMA a été créée en 1995 avec pour objectif initial l’harmonisation de l’évaluation scientifique entre États membres de l’UE. Aux côtés des agences nationales, qui sont les opérateurs directs, l’EMA assure un rôle de coordination entre États. L’EMA peut aussi délivrer des autorisations de mise sur le marché (AMM) européennes, centralisées, valables dans tous les États membres. Elle n’a en revanche pas de pouvoir de sanction. Elle ne dispose pas non plus d’un propre contingent d’inspecteurs : ses missions d’inspection mobilisent les inspecteurs issus des autorités nationales.
L’essentiel du cycle de vie (production, tarification, prescription) du médicament et du dispositif médical est finalement placé sous l’égide des agences du médicament (nationale et européenne), qui disposent d’un pouvoir d’inspection et de sanction si certains acteurs manquent à leurs obligations.
La chaîne de production et de distribution
De la recherche au conditionnement
En préalable à la production d’un médicament, des laboratoires privés ou publics assurent une phase de recherche et de développement (R&D) du produit, laquelle débouche sur des essais cliniques. Si ces derniers sont concluants, le produit obtient son homologation, condition sine qua non de sa mise sur le marché.
Démarre alors le processus de production stricto sensu . Celui-ci peut être découpé en plusieurs grandes étapes. Il débute par la production des composants du produit de santé, à partir de matières premières. Dans le cas du médicament issu de la chimie, cela correspond à la synthèse des principes actifs (API) et des excipients. Les voies de synthèse varient fortement selon les structures et groupements chimiques des composés, et peuvent faire intervenir jusqu’à plusieurs dizaines d’étapes et autant d’intermédiaires de synthèse. Les synthèses peuvent être assurées par un seul et même acteur, ou réparties entre plusieurs industriels. Dans le cas du dispositif médical, il s’agit de produire des composants (seringue, vis, etc.) à partir de matières premières (acier de grade donné, type de polymère défini, etc.).
Une fois les composants produits, vient une étape d’assemblage, dite de façonnage. Dans le cas des médicaments, la formulation nécessite de veiller au bon dosage du principe actif et à la forme galénique de la présentation produite. Par exemple, la confection de médicaments sous forme humide (comme les ampoules de verre) diffère de celle des formes dites sèches, et fait intervenir des machines-outils spécifiques. Pour les dispositifs médicaux, le niveau de complexité de l’assemblage est très variable et dépend du nombre de composants et de leur intrication : un pacemaker nécessite davantage d’étapes de façonnage qu’un masque chirurgical.
L’étape suivante, celle du conditionnement, est fortement liée à la précédente puisqu’il s’agit de maintenir sous atmosphère contrôlée le produit de santé. Dans le cas du médicament, et en particulier des formes sèches, cette étape implique de regrouper plusieurs comprimés au sein d’un même blister, et d’y adjoindre une notice ainsi qu’un emballage, tous deux variables selon le pays de commercialisation et les contraintes des autorités nationales. Par exemple, la France requiert l’apposition de sceaux sécuritaires inviolables pour garantir la traçabilité de la boîte. Certaines présentations, notamment des formes humides, peuvent nécessiter des étapes supplémentaires pour garantir l’intégrité du produit lors de son transport. Pour certains dispositifs médicaux, allant des gants aux seringues en passant par les canules, il faut prévoir une étape cruciale de stérilisation.
Une production délocalisée en grande partie en Asie
La structure de production des médicaments et produits de santé a profondément évolué depuis la fin des années 1990 (Sicos, 2023). Les laboratoires pharmaceutiques européens, comme leurs homologues américains, ont cherché à externaliser leur production, à la recherche d’économies d’échelle et d’une réduction des coûts de production. Pour cela, ils ont recours, par exemple, à des façonniers spécialisés – près de la moitié des sites de production pharmaceutique en France sont des sites de façonniers10. Si cette externalisation peut donc se faire sur le territoire national, elle s’opère en majorité à l’étranger : déjà en 2014, en France, moins d’un tiers des médicaments remboursés en France étaient façonnés sur le territoire national, selon une étude menée par le Leem (l’organisation professionnelle des entreprises du médicament) et le cabinet Roland Berger (2014).
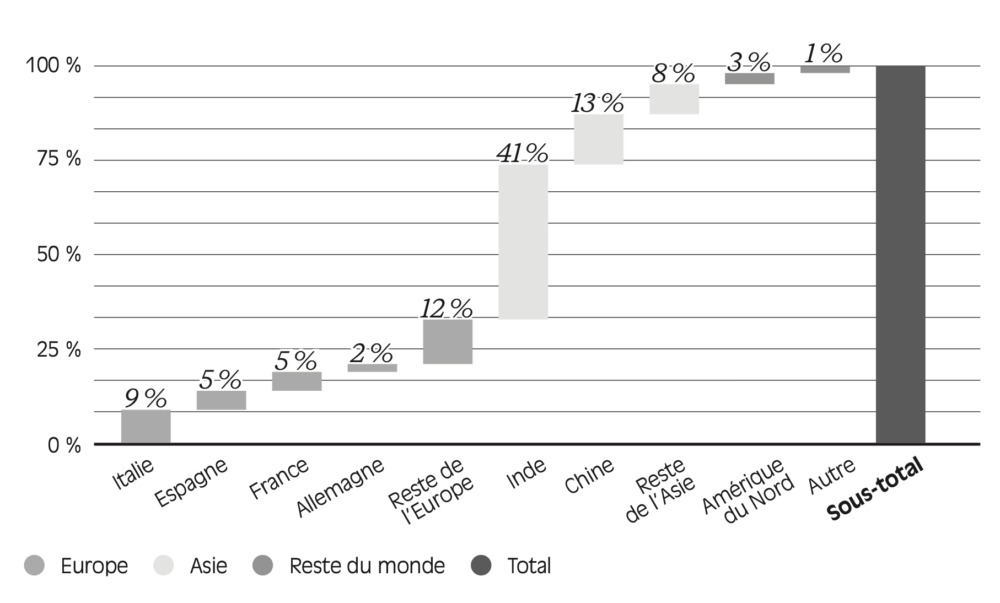
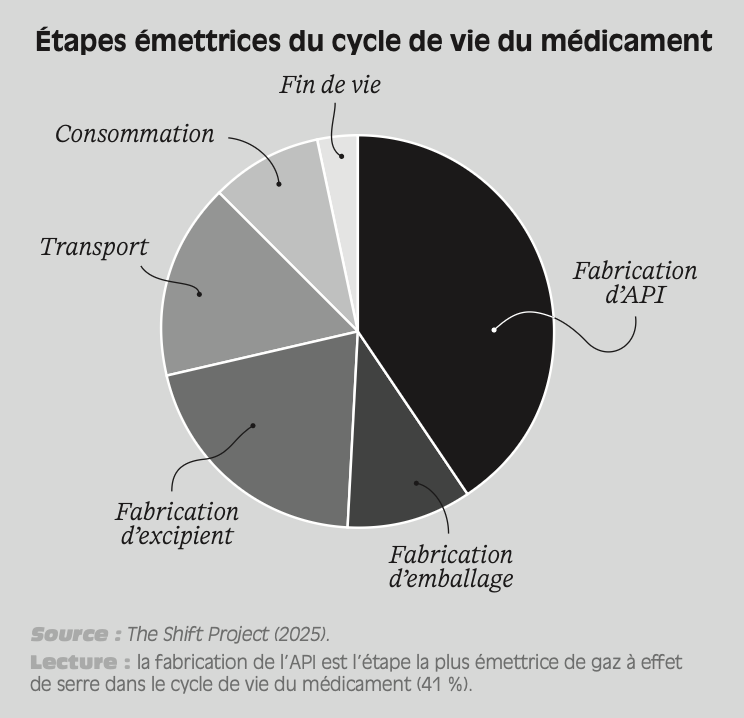
Figure 1.1 – Répartition des sites de production d’API homologués par la pharmacopée européenne (par pays ou région du monde)
Source : données reprises de Certificate Database, European Directorate for the Quality of Medicine & Healthcare. Données en date du 30 avril 2020.
Lecture : 41 % des sites de production d’API homologués par la pharmacopée européenne sont situés en Inde, contre 9 % en Italie.
Ce recours à la sous-traitance et à la délocalisation n’est pas homogène tout le long de la chaîne de production. Face à la pression sur les coûts et aux exigences environnementales, plus importantes en Europe, les laboratoires pharmaceutiques ont déplacé et sous-traité vers l’Asie les activités les plus simples et à faible valeur ajoutée, situées en amont de la chaîne de production. Ils ont davantage conservé en Europe les activités liées à la production de substances finales, en aval de la chaîne de production, dans la mesure où celles-ci nécessitent un savoir-faire technique plus spécifique (Cotterlaz et al. , 2022). Ainsi, à l’échelle mondiale, 60 % des sites de production d’API sont localisés en Asie (Sicos, 2023). Cette concentration touche naturellement les principes actifs nécessaires aux médicaments consommés en Europe. Comme l’illustre la Figure 1.1 , en 2020, 41 % des sites de production d’API homologués par la pharmacopée européenne étaient localisés en Inde, et 13 % en Chine11.
En France, une distribution très concentrée
En France, une grande partie de la distribution des produits de santé est opé- rée par des grossistes-répartiteurs qui jouent le rôle d’intermédiaires entre les industriels et les acheteurs (officines ou acheteurs hospitaliers). En France, cinq opérateurs regroupés au sein de la Chambre syndicale de la répartition pharma- ceutique (CSRP) gèrent près de 95 % du marché de la répartition12. En 2023, les grossistes-répartiteurs contrôlaient près de 60 % du chiffre d’affaires des médi- caments distribués sur le territoire français, essentiellement dans les officines. Il existe également un mécanisme de vente directe, des industriels aux acheteurs (cf. Figure 1.2), sans passer par l’intermédiaire des grossistes. En situation de tension, l’ANSM peut encadrer ce mécanisme pour certaines présentations (voir chapitre 3). Sur le marché du médicament, plus de 30 % des ventes (en valeur) sont des ventes directes auprès des hôpitaux. Indirectement, le milieu hospitalier conditionne près de 60 % de la consommation de produits de santé13, non seule- ment par l’usage en propre au sein des hôpitaux, mais également par la consom- mation induite dans les officines, notamment pour le traitement de pathologies chroniques. Les 40 % restants de la consommation de produits de santé sont le fait de la consommation « en ville », c’est-à-dire en officine sans prescription ou sur ordonnance d’un médecin non hospitalier.
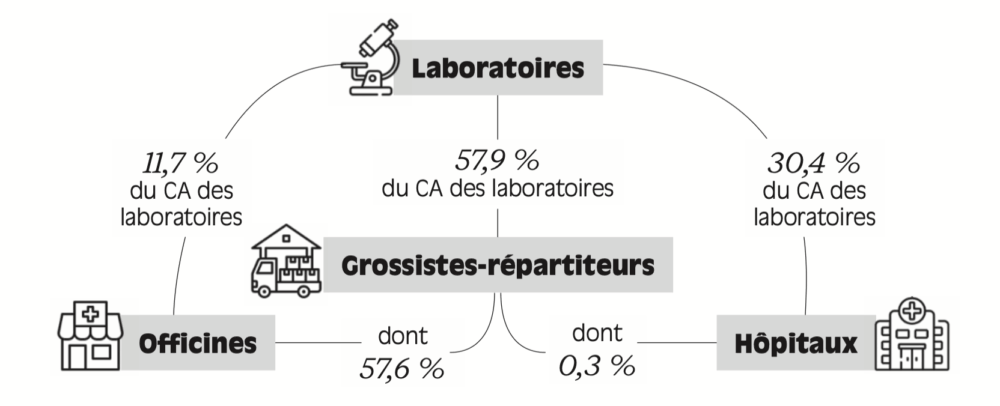
Figure 1.2 – Canaux de distribution : l’exemple du médicament
Source : Leem (2022).
Lecture : 57,9 % du chiffre d’affaires (CA) des laboratoires s’effectuent via les grossistes-répartiteurs. Les grossistes répartiteurs approvisionnent très majoritairement les officines,et marginalement les hôpitaux.
UNE DEMANDE MONDIALE PLUS DYNAMIQUE EN ASIE
La consommation ou « demande » de médicaments est poussée depuis le milieu des années 2000 par l’Asie et, notamment, la Chine et l’Inde. Cela s’explique par l’accès massif de ces pays aux produits de santé anciens (ou « matures ») et à bas coût*.
La croissance de la consommation de médicaments en Chine excédait en effet le rythme de 10 % par an à la fin des années 2000 et au début des années 2010*. Entre 2024 et 2028, la croissance de la demande en Chine et en Inde devrait continuer à dépasser largement celle de l’Europe et de l’Amérique du Nord, bien qu’elle connaisse un ralentissement marqué, avec un rythme annuel avoisinant 3,5 %.
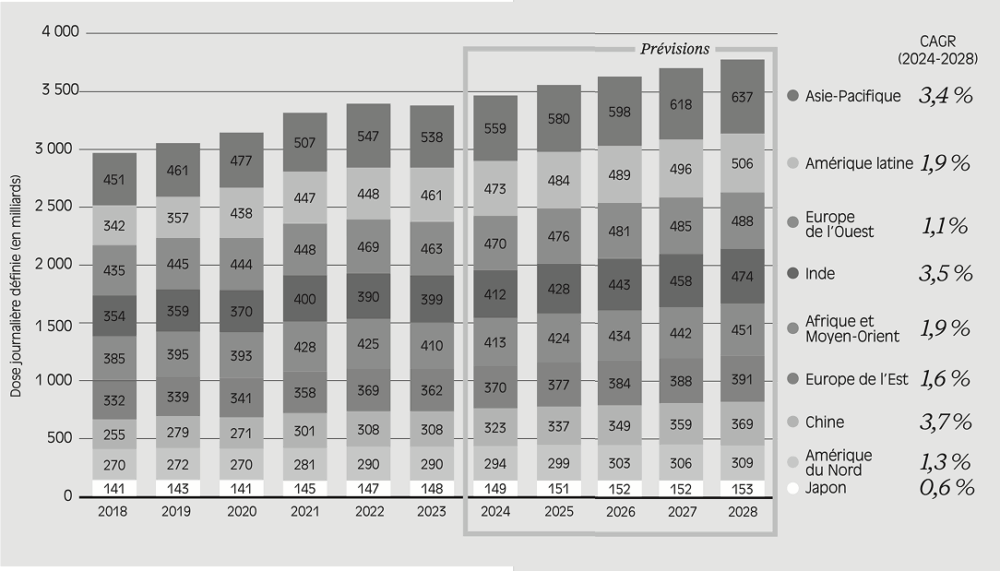
Consommation de médicaments par région du monde (2018-2028)
(*) : Source : Outlook for Global Medicines through 2021, Quintiles IMS (IQVIA), 2016.
Source : données reprises de Global Use of Medicines 2024 – Outlook to 2028, IQVIA Institute, 2024.
Lecture : en 2018, la consommation de médicaments en Asie-Pacifique a représenté 451 milliards de doses journalières définies. La dose définie journalière est une unité de mesure représentant la dose quotidienne moyenne d’un médicament utilisé pour son indication principale chez un adulte (Defined daily dose ou DDD en anglais). Cette mesure a été définie par l’Organisation mondiale de la santé (OMS).
Note : le CAGR (Compound Annual Growth Rate) est le taux de croissance annuel moyen sur une période donnée.
Entre 2024 et 2028, la croissance de la demande en Chine et en Inde devrait continuer à dépasser largement celle de l’Europe et de l’Amérique du Nord, bien qu’elle connaisse un ralentissement marqué, avec un rythme annuel avoisinant 3,5 %.
Les déterminants du prix des produits de santé
Le prix des produits de santé dépend de leur circuit de distribution mais aussi du lieu dans lesquels ils sont dispensés. Ainsi, leur prix en ville et leur prix à l’hôpital peuvent être différents.
Fixation du prix de vente des produits de santé en ville
En ville, l’industriel est libre de ne pas demander à la Sécurité sociale de rembourser son produit de santé. En tel cas, dès lors qu’elle a obtenu une autorisation de mise sur le marché, l’entreprise peut fixer librement le prix de vente de son produit, qu’il s’agisse d’un médicament ou d’un dispositif médical.
A contrario, si l’industriel souhaite que son produit de santé soit, même partiellement, remboursé par la Sécurité sociale, son prix de vente est alors administré. Dans le cas d’un médicament, l’industriel doit déposer un dossier auprès de la commission de la transparence (CT) de la Haute autorité de santé (HAS). Cette commission détermine le service médical rendu (SMR), c’est-à-dire l’efficacité absolue du médicament pour traiter une pathologie, et l’amélioration du service médical rendu (ASMR) imputable à ce médicament, soit son intérêt au regard des autres traitements disponibles. Cette évaluation est clé pour déterminer le prix du produit. En parallèle du travail de la commission de la transparence, la commission d’évaluation économique et de santé publique (CEESP) mène une étude médico-économique pour évaluer l’efficience des produits de santé innovants, qui risquent d’avoir un impact important sur les dépenses de l’Assurance maladie. Sur la base des analyses de la HAS, le comité économique des produits de santé (CEPS) négocie ensuite avec l’industriel le prix fabricant hors taxes (PFHT). Ce prix dépend non seulement de l’ASMR du médicament mais également des volumes de ventes envisagés. Par ailleurs, l’Union nationale des caisses d’assurance maladie (UNCAM) fixe le taux de remboursement du médicament par la Sécurité sociale14
La fixation du prix des dispositifs médicaux remboursables en ville se fait sur le même modèle, au terme d’une négociation entre l’industriel et le CEPS. En amont, pour être remboursable par l’Assurance maladie, le dispositif médical doit, à la demande du fabricant, être inclus à la liste des produits et prestations remboursables (LPPR).
Les quatre sortes de médicaments développés et vendus par les laboratoires
Les laboratoires pharmaceutiques organisent généralement leur activité autour de quatre types de produits. D’une part, les médicaments innovants et les biothérapies (sous brevet) nécessitent d’importants investissements en R&D et affichent une rentabilité élevée. D’autre part, les génériques sont des copies de médicaments de marque appelés princeps , dont les brevets ont expiré. Ils offrent des alternatives moins coûteuses et à rentabilité réduite. Troisièmement, il existe des médicaments de marque, qui sont encore sous brevet (et donc pas génériqués), même s’ils ne sont plus parmi les plus innovants. Quatrièmement, les médicaments en vente libre (OTC – Over the Counter ), accessibles sans ordonnance, couvrent une large gamme de besoins de santé ou de bien-être courants.
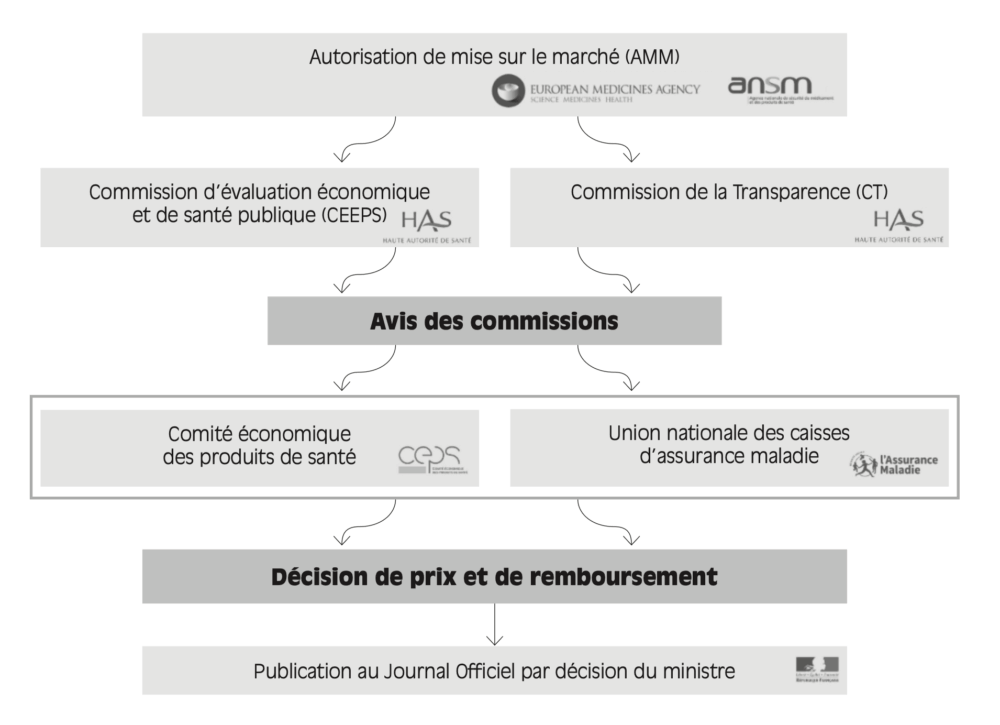
Figure 1.3 – Circuit de mise sur le marché en France et tarification des médicaments en ville
Source : ministère de la Santé, des Familles, de l’Autonomie et des Personnes handicapées.
Des marges et des négociations encadrées pour favoriser des prix bas
Le PFHT n’est pas le prix que les patients retrouvent en pharmacie. Le prix final, plus communément appelé prix public TTC, inclut également, en plus du PFHT, les marges des grossistes-répartiteurs et pharmaciens, ainsi que la TVA.
Pour les pharmaciens d’officine, le prix des médicaments remboursables pèse directement sur leur rémunération, puisque ces derniers représentaient en 2020 environ 25 % de leur marge réglementée – le reste de leur marge réglementée étant des honoraires de dispensation15 . Leur marge nette sur les produits remboursables suit un modèle dégressif, détaillé par le Leem :
• 1 0 %
• 7 %
• 5,5 %
• 5 %
• 0 %
Par exemple, pour un médicament comportant un PFHT de 10€ €, la marge réglementée du pharmacien sera de : 10 % x 1,91€ € + 7 % x (10€ € – 1,92€ €) = 0,75€ €.
Par ailleurs, le prix auquel les pharmaciens d’officine achètent les médicaments est le résultat de négociations qui sont elles aussi encadrées. Les pharmaciens d’officine peuvent en effet bénéficier de réductions de la part des grossistes-répartiteurs et des industriels, allant jusqu’à 40 % du PFHT pour les génériques, contre 2,5 % pour les médicaments non génériques. Ce mécanisme, initialement mis en place pour encourager la dispensation de génériques par les pharmaciens, augmente mécaniquement leur marge sur ces produits.
Concernant la rémunération des industriels, selon le Leem (2025), en France, plus de la moitié du chiffre d’affaires TTC des médicaments remboursables revient aux industriels. La TVA est, quant à elle, de 2,1 % pour les médicaments remboursés, même partiellement, par la sécurité sociale (contre 10 % pour ceux non-remboursables).
Perte de brevet et baisse de prix du médicament
En ville, le prix fabricant hors taxes (PFHT) négocié entre l’industriel et le CEPS évolue pour tenir compte du cycle de vie économique du médicament. Dans certains cas particuliers, les industriels peuvent faire une demande de revalorisation du PFHT au CEPS (par exemple, lorsque le modèle économique de l’industriel est sous tension et menace la production durable du médicament). Cela a notamment été mis en place temporairement pour l’amoxicilline durant l’hiver 2023-2024, alors que cet antibiotique avait été en rupture au cours de l’hiver précédent (Sagnes, 2023). Les pouvoirs publics ont consenti une revalorisation temporaire de 10 %, entre octobre 2023 et avril 2024, en contrepartie de l’engagement des fabricants à disposer de stocks suffisants pour couvrir les besoins de la population française.
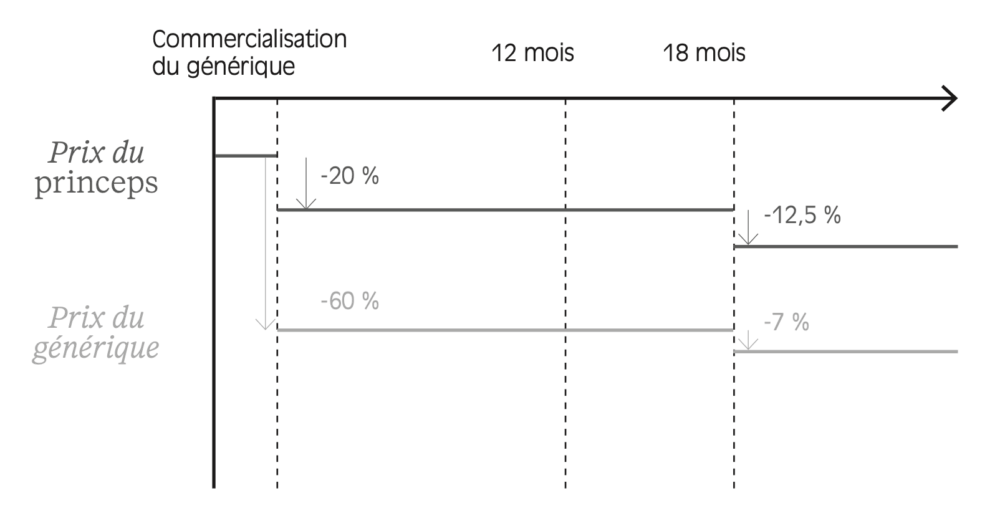
Dans le cas général, toutefois, le prix du médicament a tendance à baisser dans le temps, à mesure qu’il est l’objet d’une concurrence de plus en plus vive. Lors de sa mise sur le marché, il est sous brevet : l’industriel bénéficie donc de l’exclusivité de vente, ce qui lui permet en principe de commencer à rentabiliser les investissements qui ont été nécessaires au développement du produit, en R&D notamment. En France, la durée maximale d’un brevet est de vingt ans. Lorsque le brevet expire, des génériques peuvent entrer sur le marché. Le prix fabricant hors taxes est alors revu à la baisse, en principe de 20 % pour le princeps . Dans le même temps, si des génériques entrent sur le marché, leur prix sera fixé à 40 % du prix princeps initial. Après dix-huit mois supplémentaires d’exploitation, le CEPS peut décider d’appliquer une nouvelle baisse de prix. Cette décote est illustrée dans la Figure 1.4 . D’un point de vue économique, ces baisses de prix sont justifiées par le fait que, pour les médicaments génériques ou à maturité, les coûts de R&D ont pu être rentabilisés lors des premières années de commercialisation, comme l’explique le Leem sur son site.
De plus, ces médicaments parvenus à maturité bénéficient encore d’un effet volume. Malgré les baisses de prix appliquées en 2023, près de 70 % des ventes de médicaments remboursables en officine portaient sur des médicaments commercialisés depuis plus de dix ans, et près de 40 % des ventes portaient sur ceux commercialisés depuis plus de vingt ans (Drees, 2024).
Ces baisses de prix visent naturellement à contenir les dépenses de l’Assurance maladie tout en garantissant l’accès à des médicaments innovants, plus chers.
Figure 1.4 – Schéma de décote de prix des médicaments en France au moment de la perte de brevet et commercialisation de génériques
Source : Direction de la sécurité sociale, Leem.
Lecture : au moment de la perte de brevet et de la commercialisation du générique, le PFHT du médicament princeps est abaissé de 20 %.
Note : le prix peut être abaissé au tarif forfaitaire de responsabilité (TFR) dans certains cas, notamment si le taux de substitution du générique est trop bas.
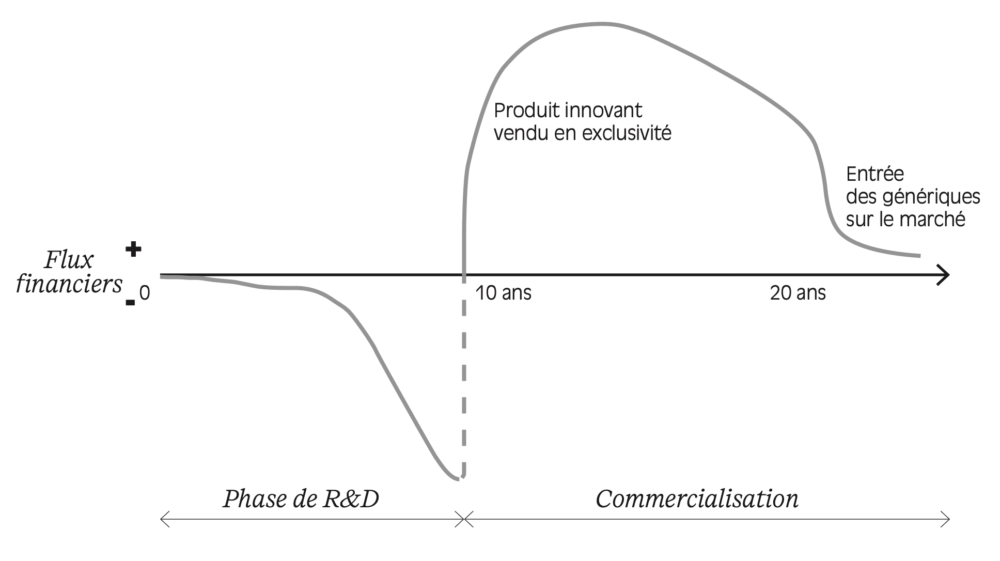
En somme, le cycle de vie économique d’un médicament inclut un investissement initial important, des premières années de commercialisation à haute rentabilité puis, après la perte du brevet, une baisse de la rentabilité dans un contexte de baisse de prix et de concurrence des génériques. La Figure 1.5 résume ce cycle
de vie économique.
Figure 1.5 – Cycle de vie économique du médicament pour un industriel
Source : Leem (2011).
Lecture : la phase de recherche et de développement (R&D) pour concevoir un nouveau médicament représente un investissement majeur pour un industriel. Les premières années de commercialisation du produit sont généralement les plus rentables ; à l’expiration du brevet, l’arrivée des génériques accentue la concurrence et le prix de vente tend alors à être révisé à la baisse.
Fixation du prix de vente des médicaments à l’hôpital
Contrairement aux médicaments vendus en ville, le prix des médicaments administrés aux patients hospitalisés n’est pas négocié par le CEPS et est donc, en principe, libre. Ils sont, en pratique, négociés entre l’industriel et les acheteurs hospitaliers (voir encadré). Les réseaux d’acheteurs hospitaliers (tels qu’UniHA et le RESAH) jouent un rôle déterminant dans la fixation des prix de vente des produits de santé aux hôpitaux, dans la mesure où ils tirent parti d’un volume de vente important pour négocier les prix auprès des industriels, affirment plusieurs des personnes que nous avons interrogées.
Les achats hospitaliers
En milieu hospitalier, les acheteurs passent des marchés à intervalles réguliers, directement avec des acteurs industriels, négocient des prix et s’engagent sur des volumes de commande. Le marché répond à un cahier des charges, et la décision d’attribution est déterminée par plusieurs critères pondérés par l’acheteur : prix, bénéfice thérapeutique, impact environnemental (marginalement), etc. Il existe plusieurs acheteurs en France, et chacun dispose d’un périmètre d’action privilégié. Par exemple, le RESAH (réseau des acheteurs hospitaliers) opère principalement en Île-de-France hors AP-HP*, tandis qu’UniHA se concentre sur le reste de la France. Les acheteurs jouent le rôle d’intermédiaire et consolident la demande, mais n’ont pas de stock en propre : les pharmacies à usage intérieur (PUI) des hôpitaux sont donc réapprovisionnées à échéances régulières directement par les industriels, selon leurs besoins.
(*) : L’AP-HP bénéficie d’une structure alternative, l’Agence générale des équipements et produits de santé (AGEPS). L’AGEPS, parmi ses multiples missions, assure l’évaluation et l’achat des produits de santé (rôle d’acheteur) mais également celui d’approvisionnement et de dispensation (rôle de PUI).
À la différence des médicaments et des dispositifs médicaux vendus en officine, ceux consommés à l’hôpital ne sont pas directement facturés à l’Assurance maladie. En effet, à l’hôpital, l’Assurance maladie couvre les frais d’hospitalisation par un forfait qui inclut l’ensemble des coûts liés à la prise
en charge des patients – ce tarif forfaitaire est censé prendre en compte le coût des médicaments et des dispositifs médicaux16.
Certaines exceptions existent toutefois, notamment pour les médicaments rétrocédables et pour les produits de santé (médicaments et DM) financés au titre de listes dites en sus (listes qui concernent certains produits de santé innovants trop onéreux pour être inclus dans les tarifs forfaitaires payés à l’hôpital). Par ailleurs, depuis 2020, le gouvernement se réserve le droit de fixer un prix maximal de vente aux hôpitaux pour certaines présentations de médicaments17.
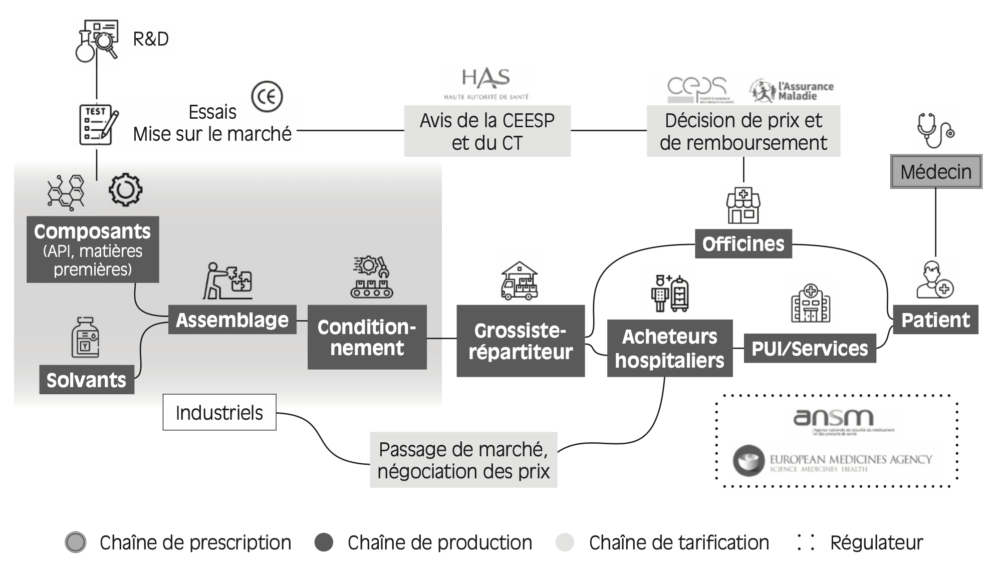
Figure 1.6 – Chaîne de valeur du produit de santé
Source : Leem (2011).
Lecture : trois chaînes d’acteurs s’entrecroisent sous l’égide du régulateur : la chaîne de production, la chaîne de tarification et la chaîne de prescription.
La clause de sauvegarde
Pour contrôler les dépenses de médicaments a posteriori , la France a introduit en 1999 une clause de sauvegarde, obligeant les laboratoires pharmaceutiques à verser une contribution à l’Assurance maladie lorsque leurs ventes agrégées de médicaments dépassent un certain seuil « M ». L’assiette de cette clause de sauvegarde a été progressivement élargie, notamment lors de l’intégration des génériques à partir de 2019. Si les ventes de médicaments dépassent le seuil « M », le montant de la clause de sauvegarde est d’abord calculé à l’échelle de l’ensemble des entreprises redevables. Cette contribution globale dépend de l’ampleur du dépassement du seuil « M ». Partant du rendement global, les contributions individuelles de chaque entreprise redevable dépendent ensuite à la fois de leur chiffre d’affaires et de leur croissance – avec un plafonnement de la contribution due par chaque entreprise18.
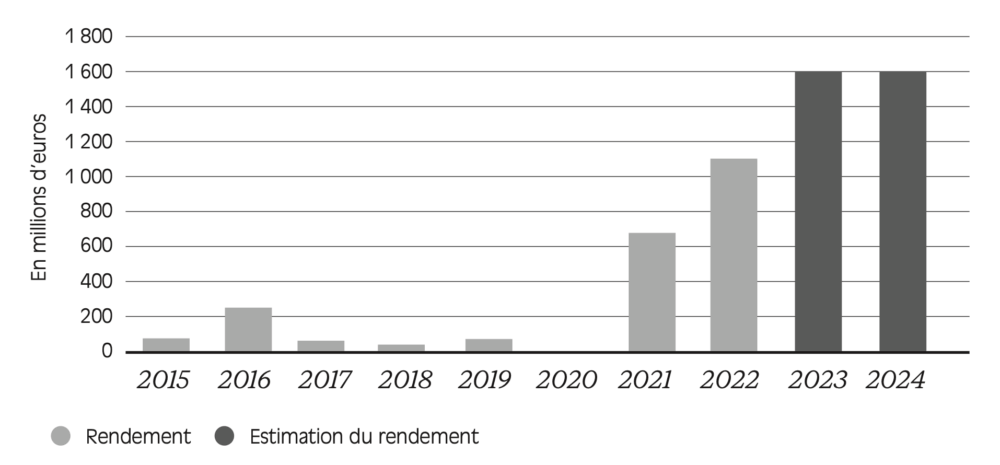
Initialement conçue pour être déclenchée exceptionnellement en cas de dépassement des prévisions de dépenses, la clause de sauvegarde a quasi systématiquement été déclenchée depuis 2015, son rendement dépassant symboliquement le seuil du milliard d’euros à partir de 2022, comme l’illustre la Figure 1.7 .
Figure 1.7 – Rendement annuel de la clause de sauvegarde (2015-2024)
Source : de La Provôté et Cohen (2023). Lecture : en 2015, le montant de la clause de sauve-garde pour les médicaments était, au total, de 76 millions d’euros.
Une clause de sauvegarde spécifique pour les dispositifs médicaux
Une clause de sauvegarde séparée pour les dispositifs médicaux a été introduite dans la loi de financement pour la sécurité sociale (LFSS) de 2020. Contrairement à son homologue relative aux médicaments, la clause de sauvegarde pour les DM s’applique au périmètre restreint des dispositifs innovants inscrits sur la liste des produits et prestations remboursés (LPPR) et pris en charge par l’Assurance maladie « en sus » des prestations d’hospitalisation. Sa mise en place a été justifiée par la forte croissance des dépenses pour ces produits entre 2012 et 2018 (plus de 4 % par an en moyenne, d’après le rapport d’activité 2022 du CEPS). Sur le même modèle que la clause de sauvegarde pour les médicaments, celle relative aux dispositifs médicaux est caractérisée par un seuil de ventes « Z » au-delà duquel une contribution est demandée aux entreprises redevables. Selon différentes sources*, le seuil « Z » a été dépassé pour la première fois en 2022.
(*) : Le rapport d’activité 2022 du CEPS et la revue de dépenses de l’inspection générale des finances et de l’inspection générale des affaires sociales.
40 % des ventes sont des génériques
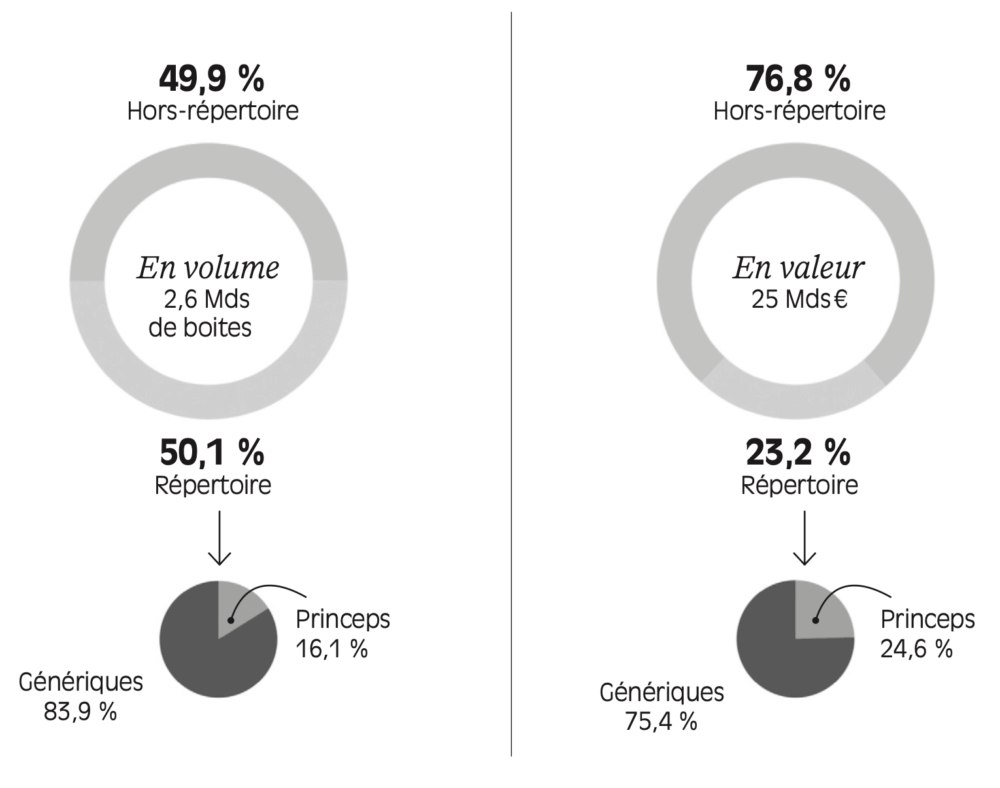
Pour avoir une vision globale du marché français du médicament, il convient enfin d’introduire le « répertoire des génériques ». Ce dernier rassemble les « groupes génériques », comprenant le médicament princeps et ses génériques (qu’ils soient commercialisés ou non en France). Comme l’illustre la Figure 1.8 , un médicament sur deux consommés en France est soit générique, soit génériqué, et figure donc dans ce répertoire. Par ailleurs, la part de marché des génériques au sein des médicaments figurant au répertoire dépasse aujourd’hui 80 % : autrement dit, quand un générique existe, il est privilégié au princeps à peu près quatre fois sur cinq. Au total, les ventes de génériques s’élèvent donc à plus de 40 % du marché du médicament en volume (80 % x 50 %) ; elles en représentent moins de 20 % en valeur.
FIGURE 1.8 – Le marché du médicament remboursable en ville en France, en volume et en valeur en 2023
Source : Leem et Direction de la sécurité sociale, d’après GERS.
Lecture : en 2023, en France, 50,1 % du marché du médicament en volume était dans le répertoire des génériques. Parmi ces ventes de médicaments inscrits au répertoire des génériques, 16,1 % étaient des princeps et 83,9 % étaient des génériques
- 4 – La thérapie par cellules CAR-T est une des immunothérapies utilisées pour le traitement des cancers du sang. Elle consiste à utiliser le système immunitaire du patient pour que ses propres lymphocytes détruisent les cellules cancéreuses. Dans cet objectif, les lymphocytes T du patient sont isolés puis multipliés et modifiés génétiquement pour cibler spécifiquement les cellules cancéreuses, avant d’être réinjectés en grand nombre au patient.
- 5 – Présentation d’un médicament, Dictionnaire médical de l’Académie de médecine.
- 6 – Source : ministère du Travail, de la Santé, des Solidarités et des Familles, 2025.
- 7 – Comité d’interface avec les représentants des industries des dispositifs médicaux et disposi- tifs médicaux de diagnostic in vitro, groupe de travail Ruptures de stock et d’approvisionnement des DM et DMDIV, ANSM, 2022.
- 8 – L’ANSM est chargée de l’autorisation de mise sur le marché et de la pharmacovigilance pour les produits de santé. La Haute Autorité de santé (HAS), quant à elle, définit le service médical rendu (SMR) et l’amélioration du service médical rendu (ASMR) qui sont des éléments essentiels pour fixer la tarification du produit de santé. Elle a également d’autres missions qui dépassent le champ du produit de santé : elle certifie notamment les établissements de santé. Il y a donc une dépendance fonctionnelle entre les deux autorités dans le circuit de mise sur le marché du produit de santé : la HAS fonde son avis d’ASMR et de SMR après l’obtention de l’AMM délivrée par l’ANSM. Il n’y a pas pour autant de dépendance hiérarchique, car la HAS est une autorité pu- blique indépendante, tandis que l’ANSM est un établissement public sous la tutelle du ministère chargé de la santé.
- 9 – L’ANSM dispose de plusieurs types de communication, selon les circonstances : une communication de crise, directement auprès des professionnels de santé, pour indiquer un retrait de lot ou une conduite à tenir, par exemple ; une communication de suivi, notamment pour les déclarations de certaines ruptures, qu’elle effectue sur l’onglet « Disponibilité des produits de santé » sur son site Internet.
- 10 – « Le marché du façonnage pharmaceutique recouvre la fabrication et le conditionnement […]. Il est structuré en France autour d’une quarantaine d’opérateurs qui détiennent plus de 80 implantations industrielles. » (Xerfi, 2025)
- 11 – Source : ProGenerika.
- 12 – Source : Chambre syndicale de la répartition pharmaceutique, 2025.
- 13 – Source : audition du 12 mai 2025 de Walid Ben Brahim, directeur général du groupement d’achat public financé par les hôpitaux, l’UniHA, dans le cadre de la Commission d’enquête sur la commande publique du Sénat.
- 14 – Voir « La fixation des prix du médicament » sur le site du ministère de la Santé, des Familles, de l’Autonomie et des Personnes handicapées, 2025.
- 15 – Source : Sécurité sociale (2020). Les comptes de la Sécurité sociale : résultats 2019, prévisions 2020 et 2021, pp.130-133.
- 16 – Plus précisément, du point de vue d’un hôpital, les frais liés à l’hospitalisation d’un patient sont couverts par les groupes homogènes de séjours (GHS). Les GHS sont des catégories tarifaires couvrant l’ensemble des coûts d’un séjour hospitalier, médicaments inclus. Le tarif forfaitaire correspondant, payé à l’hôpital, est déterminé par la nature médicale et économique des soins à prodiguer au patient. Ce mode de financement des hôpitaux provient du plan Hôpital 2007 qui a introduit la tarification à l’activité.
- 17 – Décret n° 2020-1 437 du 24 novembre 2020 relatif aux modalités de fixation du prix maximal de vente aux établissements de santé d’un produit de santé.
- 18 – Pour une explication plus technique du calcul des contributions individuelles à la clause de sauvegarde, voir également : Mission régulation des produits de santé, ministère de l’Économie des Finances et de la Souveraineté industrielle et numérique, 2023.
La pénurie d’un produit de santé, un événement protéiforme
Derrière le terme pénurie se cachent de nombreuses situations, allant de la simple rupture de stock dans quelques officines à l’arrêt de commercialisation de certains produits. Néanmoins, il apparaît que ce problème d’accès aux médicaments s’est renforcé au cours des dix dernières années, particulièrement pour les médicaments à « indication thérapeutique majeure », pour lesquels il n’y a pas d’alternative.
Pénurie : un terme fourre-tout
L’étymologie même du mot « pénurie » (du latin penuria , « le manque », lui-même issu du grec ancien πείνα , « la faim ») condamne son emploi à une certaine imprécision. Partant de ce constat, il apparaît nécessaire de présenter la terminologie employée pour refléter plus finement la grande diversité de phénomènes couramment désignés sous le même terme.
Une première distinction peut être établie selon le volume de produits concernés. Lorsqu’il existe encore du stock pour couvrir une partie de la demande mais pas son intégralité, il est possible de parler de « tension d’approvisionnement ». L’ANSM emploie également l’expression « risque de rupture ». Lorsque les stocks ne sont plus disponibles, il s’agit d’une « rupture ».
Une deuxième distinction peut être faite en fonction des acteurs concernés. Lorsqu’un laboratoire est dans l’incapacité de produire des unités supplémentaires, et qu’en outre son stock de sécurité s’amenuise, le produit est en « rupture de stock ». A contrario , lorsqu’un grossiste-répartiteur se trouve dans l’incapacité de livrer une présentation donnée à une pharmacie (officine ou PUI) pendant plus de 72 heures, la présentation est en « rupture d’approvisionnement » dans cette pharmacie. Il peut bien sûr y avoir un lien entre les deux phénomènes : une rupture de stock qui n’est pas jugulée conduit à terme à des ruptures d’approvisionnement.
Une troisième distinction concerne le champ des pharmacies concernées. Il se peut que certaines pharmacies (par exemple situées dans une région particulière, ou appartenant à un groupement d’officines, etc.) soient sélectivement frappées par une rupture d’approvisionnement ; inversement, il arrive qu’une présentation donnée soit en rupture dans toutes les pharmacies au même moment. Il n’existe pas, à notre connaissance, de terminologie ayant cours pour reconnaître ces deux phénomènes. Nous proposons d’introduire les termes de « rupture localisée » dans le premier cas et de « rupture sèche » dans le second.
Enfin, il convient de noter l’existence d’un phénomène supplémentaire : l’arrêt de commercialisation. De prime abord, la survenue de ruptures sur une présentation donnée n’a pas de raison de pousser l’industriel exploitant à arrêter sa fabrication. Mais, en sens contraire, et comme cela sera explicité plus loin, la survenue de ruptures peut être la manifestation visible d’un effort de rationalisation de la part des industriels, quand ceux-ci n’ont qu’une très faible incitation économique à conserver des capacités de production. En ce sens, l’arrêt de commercialisation peut être considéré comme le stade ultime de ce processus qui a conduit l’industriel à se dessaisir de la production d’une présentation. En dépit de dispositions discutées fin 202319 (sur le modèle de la loi Florange), contraignant les industriels à trouver un repreneur, les conséquences sont dévastatrices pour les patients, qui se retrouvent de manière définitive
en incapacité de s’approvisionner.
Les pénuries en chiffres
Une aggravation de la situation depuis dix ans, une stabilisation
depuis 2024
Si le sujet des pénuries de produits de santé a gagné en visibilité ces dernières années, c’est que les tensions d’approvisionnement se sont singulièrement aggravées.
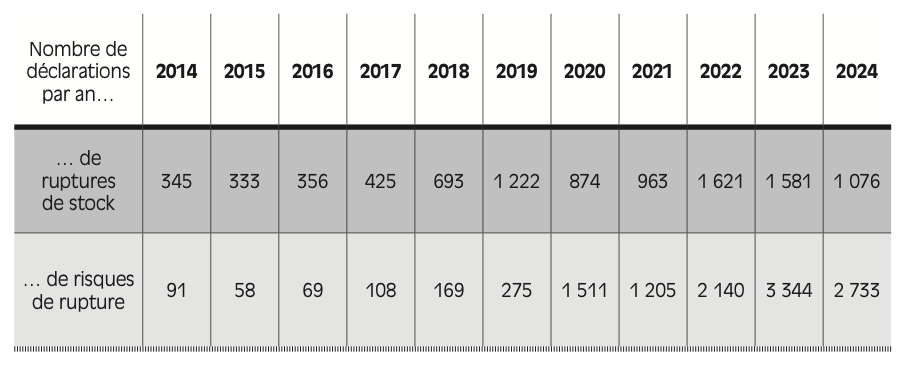
Le nombre de ruptures de stock déclarées pour des médicaments a ainsi triplé entre 2014 et 2023 en France, passant de 345 en 2014 à 1 076 en 2024, d’après les chiffres publiés par l’ANSM20 . Le nombre de risques de rupture a également fortement augmenté (passant de moins de 100 en 2014 à plus de 3 000 en 2023) – avec une hausse très marquée entre 2019 et 2020 puis entre 2021 et 2023.
Figure 2.1 – Nombre de déclarations de ruptures de stock et de tensions d’approvisionnement de médicaments par an (2014-2024)
Source : ANSM.
Lecture : en 2024, l’ANSM a recensé 1 076 déclarations de ruptures de stock de médicaments et 2 733 déclarations de tensions d’approvisionnement.
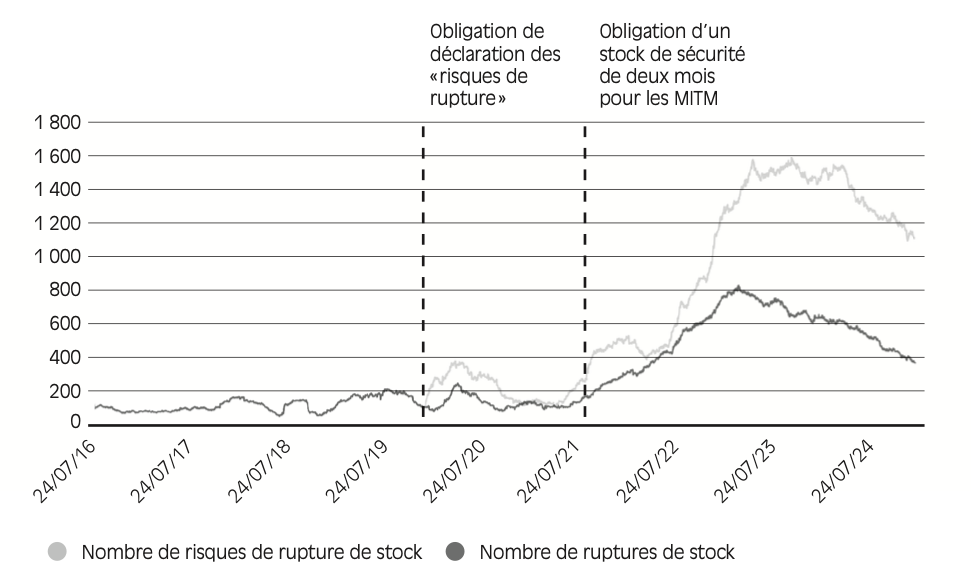
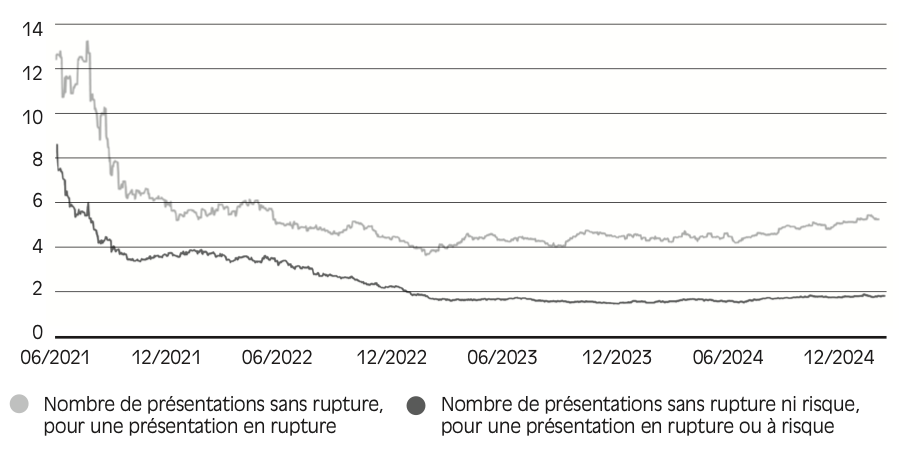
Par ailleurs, la Drees a publié une étude se concentrant sur les médicaments d’intérêt thérapeutique majeur (MITM)21 , qui représentent plus de la moitié des médicaments commercialisés en France. Cette analyse permet une compréhension plus fine des ruptures (cf. Figure 2.2 ) puisque la Drees y mesure le nombre de présentations de MITM en rupture ou risque de rupture au jour le jour – ce qui permet d’évaluer l’intensité des ruptures, plutôt que de se limiter au comptage des déclarations22.
Figure 2.2 – Nombre journalier de présentations de médicaments d’intérêt thérapeutique majeur (MITM) en rupture ou risque de rupture de stock en ville
Source : Baudet et Dherbécourt (2025).
Lecture : au 1er janvier 2025, 1 121 MITM étaient en risque de rupture de stock et 370 MITM étaient en rupture de stock.
L’augmentation du nombre de MITM en rupture ou risque de rupture de stock n’est pas linéaire. Au contraire, on observe différents « pics », dont un particulièrement marqué en 2023. Le nombre de MITM en rupture ou risque de rupture s’est alors stabilisé, puis a progressivement diminué entre 2023 et 2025. De même, le nombre total de déclarations de rupture ou risques de rupture a diminué en 2024 par rapport à 2023 (environ 3 800 déclarations en 2024, contre près de 5 000 en 2023), selon l’ANSM. La situation reste toutefois bien plus critique qu’elle ne l’était avant la pandémie de la Covid-19.
Différents éléments permettent de comprendre ces pics. D’une part, les laboratoires n’ont pas toujours été obligés de déclarer les ruptures ou risques de rupture de stock. S’agissant des MITM, les laboratoires doivent informer l’ANSM des ruptures de stock depuis 2016 et des risques de rupture depuis 2020, ce qui coïncide avec un premier pic de déclarations. Les obligations de déclaration et les sanctions auxquelles les industriels s’exposent en cas de manquement sont ainsi des éléments à considérer dans l’interprétation des courbes de la Figure 2.2 . Selon certains acteurs interrogés, l’évolution de la réglementation (avec notamment la mise en place des stocks de sécurité obligatoires) a ainsi pesé dans l’augmentation significative du nombre de MITM déclarés comme étant en « risque de rupture ».
D’autre part, l’augmentation spectaculaire du nombre de produits en risque ou en rupture durant les hivers 2021-2022 et 2022-2023, jusqu’à atteindre 800 MITM en rupture lors du pic de 2023, est à mettre en relation avec une mesure adoptée par l’ANSM à cette même période : depuis le 1er septembre 2021, les fabricants de MITM doivent constituer un stock de sécurité de deux mois. En cas de manquement, l’ANSM peut en effet prononcer des sanctions financières s’élevant jusqu’à 30 % du chiffre d’affaires hors taxes de l’exploitant, dans la limite d’un million d’euros, possiblement avec astreinte. Certains acteurs interrogés confirment une propension à déclarer le moindre incident pour ne pas tomber sous le coup de ces sanctions. Un industriel disposant d’un mois et trois semaines de stocks, et attendant une livraison de son fournisseur la semaine suivante, a en effet tendance à déclarer une tension pour ne pas courir le risque de payer une amende. Il reste difficile de déterminer quantitativement la part de cet artefact dans le pic de pénuries signalées à partir de 2021. S’il a indéniablement joué un rôle, il convient également de noter que l’aggravation « réelle » de la situation entre 2021 et 2023 a été confirmée par nos entretiens menés sur le terrain, avec des professionnels de santé et des associations de patients (France Assos Santé, 2022 ; 2024).
Une situation plus difficile à suivre pour les dispositifs médicaux
De 2021 à début 2025, la déclaration de tensions d’approvisionnement en DM de la part des industriels à l’ANSM se faisait uniquement sur la base de volontariat, rendant difficile une analyse précise de la situation. Selon le ministère de la Santé, plus d’une centaine de tensions ont été signalées à l’ANSM entre 2021 et 2024. Début 2025, une procédure de déclaration à l’échelle européenne a été mise en place pour anticiper les pénuries de dispositifs médicaux.
Les produits régulièrement en rupture : des produits anciens et peu chers
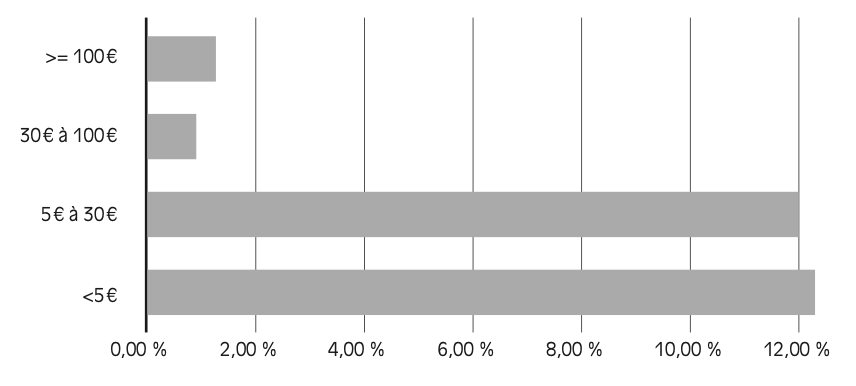
Une analyse des données du Groupement pour l’élaboration et la réalisation de statistiques (GERS, 2024) – servant de référence dans les accords entre le Leem et le CEPS – fait apparaître que les produits parvenus à maturité sont particulièrement exposés aux ruptures. En volume, 77,9 % des ruptures concernent des molécules commercialisées depuis plus de vingt ans (dont le brevet a donc expiré). En outre, la grande majorité des présentations en rupture affichent un prix fabricant hors taxes (PFHT) inférieur à 5 euros (83,5 % des pénuries en 2023).
Comme le montre la Figure 2.3 , les classes de prix les plus faibles sont, en volume, les plus touchées par les tensions et les ruptures : près de 12 % des boîtes de médicaments dont le PFHT est inférieur à 30 euros ont été en tension ou en rupture au cours de l’année 2023, contre environ 1 % pour celles dont le PFHT est supérieur à 30 euros. L’exemple emblématique de la quétiapine, un antipsychotique qui a été en rupture en 2025 et dont les causes de la pénurie sont développées dans le chapitre 3, illustre cela : en 2025, le princeps était commercialisé à 20,62 euros TTC, contre 10,07 euros TTC pour les génériques
(et donc des PFHT encore inférieurs).
Figure 2.3 – Part du volume en rupture ou en tension par tranche de PFHT
Source : GERS (2024).
Lecture : en 2023, environ 12 % des volumes de médicaments présentant un PFHT inférieur à 5 euros ont été déclarés en rupture ou en tension.
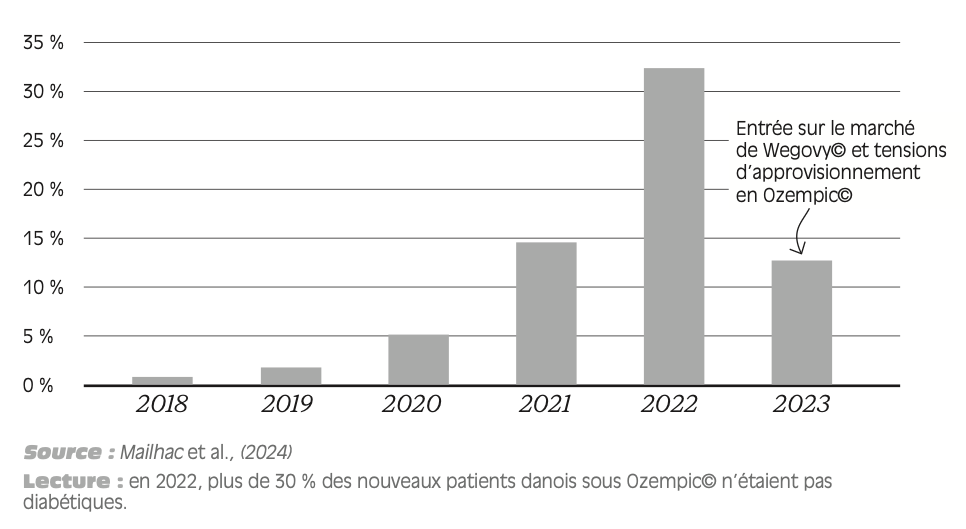
À rebours de ces grandes tendances, certains contre-exemples de ruptures particulièrement médiatisées ont concerné des médicaments innovants et plus chers, tels que le sémaglutide, utilisé pour le traitement du diabète de type 2, ou l’Ozempic© (Brafman, 2023a) dont le PFHT est supérieur à 70 euros (voir plus loin).
Une criticité des pénuries qui dépend de nombreux paramètres
Comme évoqué plus haut, il existe différents types de pénuries, qui n’affectent pas les patients de la même manière. L’effet d’une pénurie sur la santé publique dépend de différents facteurs.
Le premier paramètre important est le nombre d’alternatives thérapeutiques disponibles. Une rupture affecte d’autant plus les patients que peu d’alternatives existent. D’après les chiffres de la Drees (2025), les ruptures sont en moyenne plus sévères en France en 2024 qu’en 2021. En effet, en 2021, pour une présentation en rupture de stock ou en tension, on comptait environ huit alternatives disponibles. Ce chiffre est passé à 1,6 en 2023. Nous observons, toutefois, une stabilisation de la situation depuis cette date, voire une légère amélioration depuis 2024 avec 2 alternatives disponibles par présentation. Autrement dit, la baisse du nombre de pénuries déclarées à partir de fin 2023 n’a pas induit d’augmentation significative du nombre d’alternatives disponibles. Pour les pharmaciens, cela se traduit concrètement par des difficultés à trouver des alternatives thérapeutiques en cas de rupture.
Le deuxième facteur à prendre en compte tient à la durée de la pénurie. Selon la même étude de la Drees, les pénuries durent en moyenne six mois. Ce chiffre cache toutefois une forte disparité : certains produits peuvent être en tension pendant quelques jours ou semaines, tandis que d’autres ruptures ont duré plusieurs années. Par exemple, certaines présentations injectables du méthotrexate, un anticancéreux utilisé massivement, sont en rupture de stock depuis juin 2022 – soit, à la date d’écriture de cet ouvrage, depuis trois ans23.
Le troisième facteur est celui de la criticité des pathologies traitées par le produit. En cas d’indication du produit pour de multiples pathologies, c’est celle qui présente le plus grand risque qui est généralement prise en compte pour qualifier sa criticité. Si des populations fragiles (personnes âgées, enfants, etc.) sont particulièrement consommatrices du produit concerné, c’est également pris en compte. C’est ce qui explique par exemple la couverture médiatique des tensions observées en paracétamol pédiatrique en 2022, en France (Franceinfo , 2022).
Enfin, un dernier facteur concerne la position de l’acteur défaillant sur le marché. Plus celui-ci a une grande part de marché, plus la rupture risque d’affecter un grand nombre de patients. Dans le cas des outils de diagnostic in vitro (DM/DIV), l’ANSM considère qu’un acteur est en position dominante dès lors qu’il détient plus de 50 % du marché national ou que sa part de marché est largement supérieure à celle de ses concurrents.
Figure 2.4 – Nombre moyen d’alternatives médicamenteuses aux ruptures et risques de rupture (secteur ville, France)
Source : Drees (2025).
Lecture : au 1er janvier 2025, pour une présentation en rupture de stock ou en tension, on compte en moyenne environ deux présentations de même classe-forme sans risque ni rupture. À la même date, il existe en moyenne un peu plus de cinq présentations de même classe-forme sans rupture
pour chaque présentation en rupture.
Note : une classe-forme définit l’ensemble des présentations de même classe thérapeutique.
Produits captifs, un élément spécifique à considérer pour les DM
Pour les dispositifs médicaux, un autre facteur de criticité considéré par l’ANSM est le caractère captif du produit. Cela fait écho aux enjeux de substituabilité des DM évoqués en chapitre 1. Un dispositif captif est un produit conçu pour être utilisé avec un autre appareil spécifique, typiquement pour des raisons de compatibilité. Par exemple, certains stylos injecteurs d’insuline sont conçus pour être utilisés avec des cartouches d’insuline spécifiques. En cas de pénurie de celles-ci, les stylos ne sont plus opérationnels. Un autre exemple est celui de seringues qui peuvent être captives de certains types de pousse-seringues.
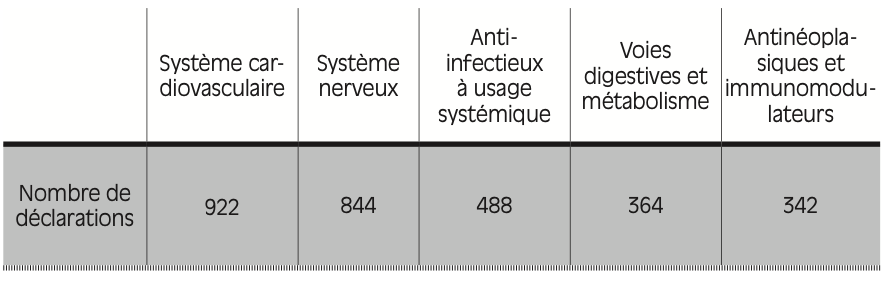
Figure 2.5 – Nombre de déclarations de ruptures ou risques de rupture de stock pour les 5 classes thérapeutiques les plus touchées, en France, en 2024
Source : ANSM.
Lecture : en 2024, 922 déclarations de ruptures ou risques de rupture de stock ont concerné des médicaments traitant de pathologies du système cardiovasculaire. Cette classe thérapeutique a été la plus touchée par les pénuries en 2024, en France.
L’analyse des déclarations de rupture et de tension par les industriels révèle également que l’ensemble des classes thérapeutiques24 sont touchées par les pénuries, quand bien même certaines le sont plus que d’autres. Les deux classes les plus représentées dans les pénuries – système cardiovasculaire et système nerveux – traitent souvent de maladies chroniques, qui nécessitent un traitement prolongé selon l’ANSM. La troisième classe thérapeutique la plus touchée est celle des anti-infectieux, ce qui peut s’expliquer notamment par une consommation d’antibiotiques très importante en France (voir plus loin).
Enfin, un dernier aspect à considérer est la forme galénique des médicaments : certains experts rencontrés en entretien tout comme les dernières études quantitatives sur le sujet s’accordent à dire que les produits à plus forte technicité (stérile, injectable…) sont relativement plus touchés que les autres (Audier et al. , 2023).
Un système d’alerte peu lisible
Aujourd’hui en France, il est très difficile d’obtenir instantanément un état des lieux des ruptures et tensions concernant les produits de santé. Ce manque de visibilité est d’ailleurs partagé par les acteurs du monde médical eux-mêmes : de nombreux médecins sont informés directement par leurs patients de leur incapacité à s’approvisionner en pharmacie. Il faut dire que les déclarations individuelles de rupture ne sont pas systématiquement publiées sur le site de l’ANSM, et certains professionnels de santé confessent leur peine à trouver la marche à suivre.
La situation est encore plus problématique pour les DM car l’ANSM dispose d’un contingent d’agents bien plus faible que pour les médicaments25 alors qu’il existe davantage de références. L’exemple des ruptures d’approvisionnement en sondes urinaires Coloplast (pour défaut de stérilité) est en cela révélateur : une rupture a été annoncée le 13 décembre 2024 et plusieurs pharmacies d’hôpital (PUI) ont dû trouver en urgence des substituts. L’ANSM n’a publié officiellement sur son site la conduite à tenir que le 26 décembre 2024, soit deux semaines plus tard.
Des déclarations incomplètes ou obscures
Ce manque de clarté informationnelle se retrouve dans les documents déclaratifs transmis par les industriels à l’ANSM. En 2023, la commission sénatoriale d’enquête « Pénuries de médicaments » soulignait déjà le manque de complétude des plans de gestion de pénurie (PGP) transmis par les industriels (de La Provôté et Cohen, 2023). Ces PGP, obligatoires pour les MITM (plus de 8 000 présentations parmi les 13 000 circulant en France), peuvent être lacunaires, notamment en ce qui concerne l’analyse des risques de rupture. Faute de scénario d’action en cas de problème industriel, il n’est pas étonnant que l’ensemble des acteurs puisse être pris par surprise. Enfin, tandis que les industriels sont invités à signaler la cause de leur rupture d’approvisionnement dans le formulaire, les données de l’ANSM révèlent que près de 25 % des ruptures constatées sont renseignées avec une cause « autre ». Cette imprécision complique encore un diagnostic déjà ardu.
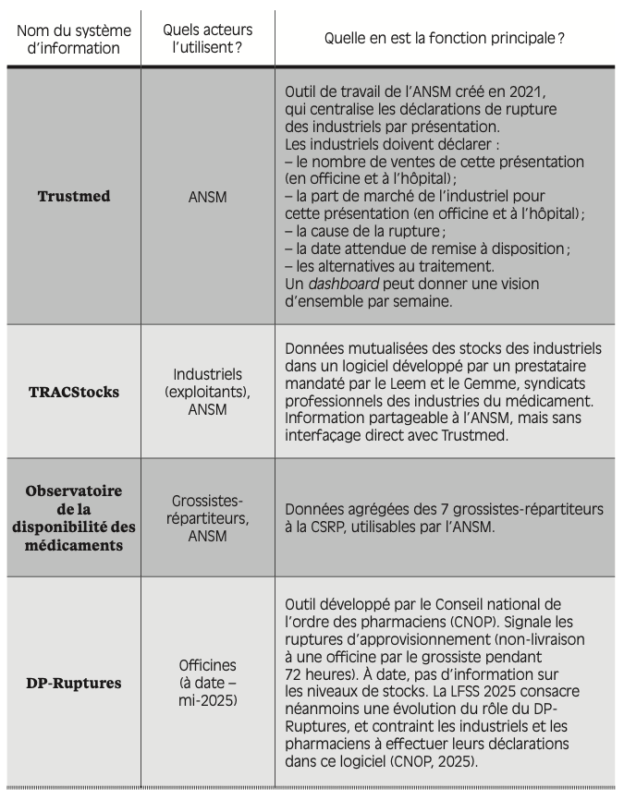
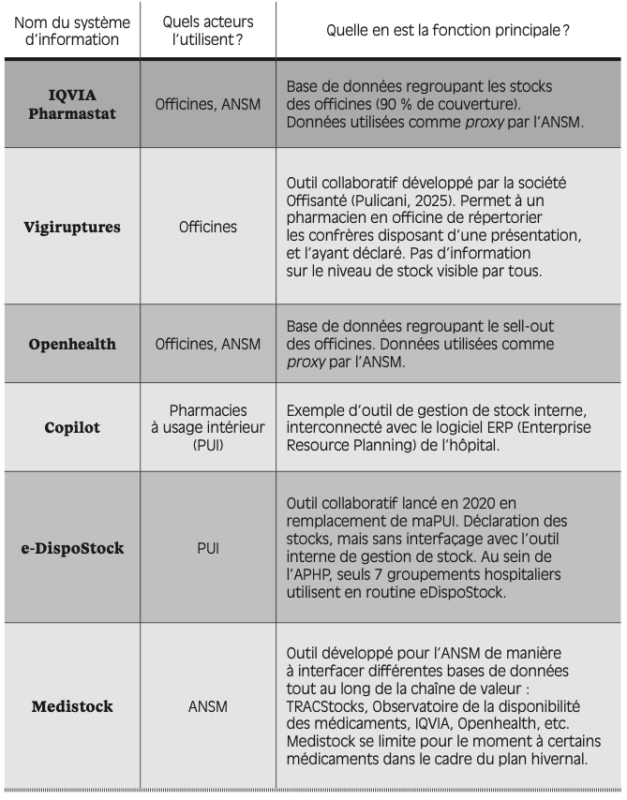
Différents systèmes d’information, comme autant de vases clos
Un paramètre supplémentaire vient obscurcir le suivi des situations de rupture, à savoir la diversité des systèmes d’information (SI) tout au long de la chaîne de valeur. Il existe à ce jour de nombreux outils, utilisés par divers acteurs, mais n’ayant pas tous la même finalité (voir annexe IV).
En dépit de cette abondance, il n’existe pas, à ce jour et à notre connaissance, de système d’information visant à renseigner directement le patient d’éventuelles ruptures. Le prescripteur est également mis à la marge : les entretiens menés en milieu hospitalier soulignent le mauvais interfaçage entre les logiciels de gestion des stocks des PUI et les logiciels de prescription des médecins hospitaliers. L’information circule donc assez mal entre les acteurs concernés et l’utilisateur final du médicament. Les patients et médecins consultés nous ont confié recourir aux retours du terrain ainsi qu’aux communiqués de la DGS ou de l’ANSM pour se tenir informés des ruptures.
Les interconnexions entre les logiciels ne sont pas meilleures en amont de la chaîne. Par exemple, TRACStocks n’est pas directement interfacé avec l’outil de l’ANSM, Trustmed. Les industriels effectuent donc deux déclarations distinctes, sans compter celle qui sera a priori requise au sein de la nouvelle version du DP-Ruptures. À ce jour, seul Médistock intègre des données issues d’acteurs variés, mais sur le périmètre très restreint du plan hivernal. De même, la séparation entre le circuit officinal et le circuit hospitalier est frappante : aucun logiciel ne permet de suivre avec précision ces deux secteurs en parallèle.
De sorte qu’un même acteur de la chaîne peut se trouver face à une grande variété de systèmes d’information peu ou mal connectés entre eux ; l’exemple des pharmacies hospitalières (PUI) est en cela frappant. Certaines PUI peuvent utiliser jusqu’à huit logiciels en routine, dont deux à trois pour le seul sujet des ruptures. Mentionnons en outre le double suivi des stocks dans Copilote et dans e-DispoStock, qui mobilise chaque semaine des pharmaciens hospitaliers pendant plusieurs heures.
Le coût de gestion des pénuries : la grande inconnue
Au-delà du temps passé par les professionnels de santé à suivre et gérer les ruptures de produits de santé, se pose, plus généralement, la question du coût pour l’État de ces situations de non-approvisionnement.
À notre connaissance, aucune étude ne s’est encore intéressée au coût agrégé de la gestion des situations de pénurie pour le système de santé en France. Or, il semble intuitif que les divers mécanismes mis en place pour gérer et endiguer les pénuries sont coûteux, tant pour les industriels que pour le système de santé.
Pour les industriels, les nombreux systèmes d’information utilisés pour signaler et renseigner les pénuries demandent du temps (informations à transmettre, parfois manuellement, à l’ANSM, etc.). En outre, les stocks obligatoires sont coûteux pour les industriels à différents égards : d’une part, des liquidités sont immobilisées en maintenant constamment des stocks parfois jugés disproportionnés par les industriels ; d’autre part, en raison des dates d’expiration des boîtes et des mises à jour périodiques des notices d’information des médicaments, les industriels doivent faire surveiller et s’assurer de la rotation de leur stock, ce qui occasionne des coûts supplémentaires.
Pour les professionnels de santé, les pénuries induisent des coûts de gestion parfois importants. Les pharmaciens en sont les premiers affectés : selon un sondage réalisé à l’échelle européenne en 2024 (PGEU, 2024), les pharmaciens d’officine passent plus de dix heures par semaine à gérer des situations de pénuries (identification et achat des alternatives thérapeutiques, discussions avec les médecins pour trouver des alternatives, etc.). À l’hôpital, plusieurs pharmacies hospitalières consultées dans le cadre de ce travail ont déclaré consacrer entre 0,5 et 1 équivalent temps plein (ETP) à la gestion des pénuries.
Les médecins interrogés témoignent également du temps que leur accapare la gestion de ces pénuries, notamment en ville, où les pharmaciens d’officine sont amenés à les contacter lorsque le traitement d’un de leurs patients est indisponible.
Au-delà de ces coûts salariaux, plusieurs solutions palliatives aux pénuries ont des coûts bien supérieurs à leurs équivalents industriels : c’est le cas des préparations magistrales réalisées par les pharmaciens d’officine, dont le coût peut être six à dix fois supérieur à celui de la présentation commercialisée (Tassain, 2023).
Aux États-Unis, la gestion des pénuries coûterait annuellement près de 900 millions de dollars aux hôpitaux américains (Vizient, 2025). Si un parallèle direct avec la France n’est pas évident, en raison des différences de coûts salariaux et de prix des médicaments, cela illustre tout de même l’importance d’estimer le coût de gestion des pénuries en France.
Finalement, les pénuries pénalisent naturellement les patients, qui ne peuvent pas toujours avoir accès à leurs traitements. Médecins, pharmaciens et associations de patients ont témoigné de situations où des patients sont contraints de se rendre dans cinq à dix pharmacies pour se procurer un traitement en tension d’approvisionnement. Au-delà du temps que cela leur prend, ces tensions sont anxiogènes pour les patients qui se voient parfois dans l’incapacité de suivre le traitement dont ils ont besoin. In fine , les pénuries augmentent significativement les risques de non-observance des traitements par les patients (modification, report, voire abandon du traitement), révèle une étude réalisée par BVA pour France Assos Santé (2019).
- 19 – Article L5124-6, Code de la santé publique, Légifrance.
- 20 – Les industriels déclarent les ruptures de stock et tensions d’approvisionnement pour les présentations qu’ils commercialisent.
- 21 – Les MITM « sont des médicaments ou classes de médicaments pour lesquels une interruption de traitement est susceptible de mettre en jeu le pronostic vital des patients à court ou moyen terme, ou représente une perte de chance importante pour les patients au regard de la gravité ou du potentiel évolutif de la maladie » explique sur son site l’ANSM.
- 22 – En effet, l’ANSM publie sur son site le nombre de déclarations de ruptures de stock (cf. Figure 2.1). Cette métrique est plus simple à manier, mais elle compte indifféremment une rupture qui ne dure que quelques jours et une rupture de plusieurs mois ou années.
- 23 – Source : ANSM.
- 24 – Les médicaments sont classés par « classe thérapeutique » selon l’organe, le système
sur lequel ils agissent et leurs caractéristiques chimiques. - 25 – Organigramme, ANSM, 2024.
Des pénuries aux causes multiples
Notre travail révèle en première instance que les ruptures sont directement liées au manque de redondance dans la chaîne d’approvisionnement. Mais cette première analyse dissimule des causes racines plus profondes et multifactorielles.
Les causes directes des ruptures : des défaillances ponctuelles
dans des chaînes de production peu redondantes
Lorsqu’une rupture survient, l’analyse des événements met généralement
au jour une défaillance ponctuelle d’un acteur de la chaîne de production.
Des défaillances sur tous les maillons de la chaîne, aggravées par une forte concentration des acteurs
S’agissant des causes des pénuries, l’ensemble du corpus d’entretiens et des cas pratiques étudiés permet d’aboutir à deux conclusions. La première est que tous les maillons de la chaîne de production peuvent être affectés par ces défaillances ponctuelles (cf. Figure 3.1 ). La deuxième est que ces dernières sont très souvent associées à une non-redondance des acteurs sur le maillon en question. En d’autres termes, l’acteur défaillant était le seul à remplir son rôle (de fabricant d’API, de façonnier, de conditionnement, etc.), ou bien concentrait une écrasante part du marché à l’échelle mondiale. Lorsqu’un incident industriel survient, et que cet acteur se trouve dans l’impossibilité d’assurer sa tâche, il n’en existe pas d’autre sur le marché capable de reprendre la production, ou alors ceux qui existent ont des capacités tellement plus réduites qu’ils ne parviennent pas à ajuster rapidement leur production face à ce choc de demande.
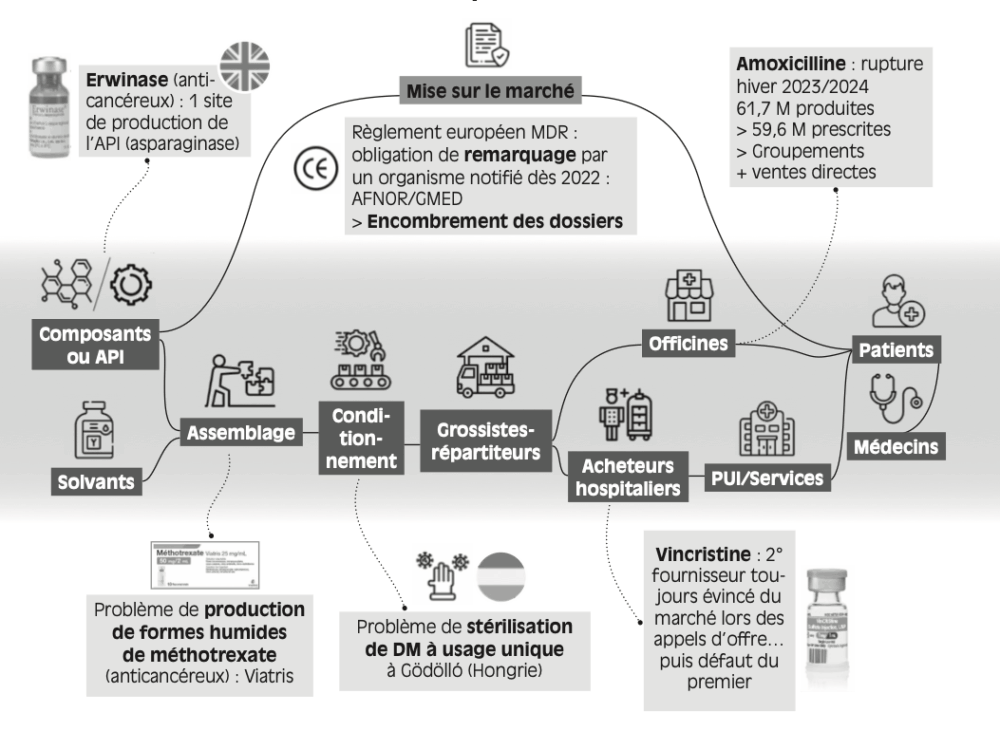
Figure 3.1 – Des exemples de défaillances dans des chaînes peu redondantes
Illustrons ces deux affirmations par des exemples, observés depuis 2018, en commençant par l’étape de la production d’API. Erwinase® est un antinéoplasique commercialisé par Jazz Pharmaceuticals, utilisé dans le traitement de la leucémie aiguë lymphoblastique. Le principe actif, le crisantaspase, est commercialisé par un unique laboratoire anglais : Porton Biopharma. À plusieurs reprises entre 2018 et 2022, des retards de livraison du principe actif ont conduit à des ruptures de stock d’Erwinase®, nécessitant des mesures d’urgence de la part de l’ANSM (Vidal, 2018). L’absence de producteur d’API alternatif a vraisemblablement conduit à la récurrence de situations de tension sur plusieurs années.
À l’étape du façonnage ensuite, citons l’exemple déjà mentionné de la quétiapine, un antipsychotique utilisé dans le traitement des troubles schizophrène et bipolaire, mais aussi en traitement de l’anxiété. Chaque année, 2,5 millions de boîtes sont consommées en France par plusieurs centaines de milliers de patients. Le princeps , développé par AstraZeneca et revendu à l’entreprise allemande Cheplapharm, ainsi que la plupart des présentations génériques, ont partiellement ou totalement recours au même façonnier grec : Pharmathen. Un défaut qualité chez ce fabricant a entraîné des ruptures en chaîne pour la plupart des présentations26 . Même s’il existait des alternatives de façonnage, elles ne suffisaient pas à empêcher la pénurie car Pharmathen concentrait en volume une grande part du marché.
S’agissant de l’étape suivante du conditionnement, il arrive qu’un produit de santé ne puisse pas être commercialisé si son conditionnement n’est pas adéquat. L’usine hongroise de Gödöllő, du génériqueur Teva, en a fait les frais (RAPS, 2016) : spécialisée dans le conditionnement de composés stériles, elle a subi plusieurs défaillances qui ont empêché la bonne livraison de produits.
Enfin la non-redondance des acteurs ne concerne pas uniquement les entreprises productives. Rappelons en effet que les acheteurs hospitaliers s’approvisionnent en gros, en passant des marchés. Il est fréquent qu’un tel acheteur décide de ne retenir qu’un fournisseur à l’issue de son appel d’offres : on parle alors de monoattribution du marché. Si un deuxième fournisseur, notamment dans le cas des TPE-PME, a candidaté à l’appel d’offres sans être retenu, il n’a pas d’incitation à maintenir ses capacités de production pendant plusieurs mois voire plusieurs années, le temps que ce marché perdu parvienne à échéance et qu’il puisse de nouveau tenter sa chance. C’est en tout cas une critique qui est reprise par certains acteurs27 (de La Provôté et Cohen, 2023). Ce deuxième fournisseur n’a évidemment aucune garantie d’être sélectionné lors du marché suivant, d’autant moins que ces années de non-production induisent une perte de savoir-faire industriel. Nous mesurons à l’aune de ces témoignages combien le mécanisme même de monoattribution entretient, tout en la renforçant, l’éviction des fournisseurs alternatifs. L’exemple de la vincristine, alcaloïde utilisé en chimiothérapie, en offre une illustration : le passage d’un marché avec un fournisseur unique a conduit, lorsque ce dernier a fait défaut, à des ruptures en série car les fournisseurs alternatifs n’étaient plus en mesure de servir la demande (Vidal, 2017).
Des délocalisations qui n’intensifient pas les pénuries ?
Plusieurs experts interrogés s’accordent à dire que la délocalisation de la production n’est pas un facteur aggravant des pénuries de produits de santé : les chaînes d’approvisionnement chinoises ne sont, par exemple, pas plus sujettes aux accidents industriels que leurs concurrentes européennes. Toutefois, ces experts soulèvent des problèmes épisodiques de traçabilité et de pharmacovigilance auprès de producteurs indiens.
En définitive, ce n’est pas la délocalisation en elle-même qui accroît le risque de pénurie mais plutôt la perte de redondance associée à ce mouvement d’externalisation hors d’Europe : par exemple, si plusieurs fabricants européens sont, pour des raisons de coût, remplacés par un unique producteur chinois.
Bien que cela ne constitue ni une panacée, ni une garantie pour endiguer l’ensemble des pénuries, une production européenne permettrait de réduire la dépendance aux importations et ainsi de sécuriser un approvisionnement plus résilient en produits de santé, notamment dans des contextes de crise mondiale ou de rupture logistique (Millet, 2022). Comme l’a illustré la crise du Covid-19, en période de forte tension, certains pays peuvent suspendre les exportations de produits de santé pour privilégier leur marché intérieur – l’Inde a, par exemple, arrêté l’exportation de plusieurs molécules en mars 2020, en pleine crise mondiale (Delacroix, 2020).
Il est donc clair que la non-redondance des acteurs tout au long des chaînes de production, sans être responsable des accidents industriels eux-mêmes, explique pourquoi ces derniers provoquent de plus en plus souvent des épisodes de rupture : l’absence de redondance signifie que l’ensemble de la chaîne est vulnérable. Sans acteur de secours, il n’y a pas de relais possible en cas de défaillance.
Des mécanismes qui aggravent les défaillances observées
En plus de la non-redondance évoquée ci-dessus, deux mécanismes supplémentaires contribuent à aggraver les tensions sur le marché des médicaments et des dispositifs médicaux.
Les ventes directes déséquilibrent la répartition des stocks en officine
Lors de l’hiver 2023-2024, des ruptures d’approvisionnement en amoxicilline, antibiotique à spectre large, ont été observées sur l’ensemble du territoire français. Pourtant, selon le syndicat des fabricants de médicaments génériques, le Gemme, le nombre de boîtes produites était supérieur au nombre de boîtes prescrites : 61,7 millions contre 59,6 millions, soit un différentiel de près de 2 millions de boîtes.
Le mécanisme de vente directe, c’est-à-dire de vente de boîtes directement des industriels aux officines sans passer par les grossistes-répartiteurs, a été mis
en cause à cette occasion. Comme l’a révélé le reportage Cash Investigation du 9 janvier 202528, dans lequel était interrogé Gilles Bonnefond, président de l’Union de syndicats de pharmaciens d’officine (USPO) de 2011 à 2021, les ventes directes auraient conduit certains pharmaciens à surstocker, les exploitants leur garantissant un approvisionnement préférentiel en amoxicilline s’ils achetaient en même temps un certain montant d’autres produits. Certaines officines ont donc accumulé des surstocks, quand d’autres n’étaient pas approvisionnées.
Cet épisode de rupture a conduit à la mise en place d’une charte d’engagement des acteurs de la chaîne du médicament pour un accès équitable des patients
aux médicaments, à l’initiative du ministre de la Santé, Aurélien Rousseau29.
Cet engagement souligne, entre autres, la nécessité de passer par l’intermédiaire des grossistes-répartiteurs pour assurer une distribution juste des produits
au sein du territoire français. En 2025, l’amoxicilline était de nouveau disponible en volumes suffisants, selon l’ANSM.
Des exigences réglementaires coûteuses concernant les dispositifs médicaux
Si les pénuries de dispositifs médicaux sont, nous l’avons vu, difficiles à quantifier, plusieurs des personnes que nous avons interrogées nous ont indiqué que la mise en place du règlement européen MDR (voir chapitre 1) a certainement favorisé certaines d’entre elles en ajoutant une couche de complexité supplémentaire à des acteurs déjà sous tension.
Le MDR, paru en 2017, entend apporter une réponse aux scandales sanitaires qui ont éclaboussé le secteur du dispositif médical à partir des années 2000,
et en particulier celui des prothèses PIP qui a mis en cause la responsabilité d’un organisme de certification allemand (Le Monde , 2012). Le règlement vise, entre autres, à renforcer les exigences pour l’obtention du marquage CE.
La première version du MDR prévoyait un agenda serré, mettant en péril la capacité des exploitants à s’adapter dans les temps : initialement, la fin de la période de transition pour la mise en conformité était prévue en avril 2024. Face au risque anticipé de ruptures en série, certaines classes de DM ont pu, sous certaines conditions, voir cette échéance reportée à 2027 ou 2028. Malgré cet ajustement, dans un écosystème constitué à 93 % de TPE-PME, les contraintes normatives ainsi que les délais et coûts associés (le coût initial de certification d’un seul produit varierait entre 200 000 et 600 000 euros selon la Commission européenne (Snitem, 2024a)) pèsent sur les performances des entreprises. À tel point que, d’après une étude du Snitem (2023), 51 % des entreprises consultées ont déjà envisagé ou déclenché un arrêt de commercialisation. Certains exploitants recourent donc à la rationalisation de gamme et cessent d’approvisionner le marché car leur portefeuille n’est plus rentable.
Des conditions économiques qui n’encouragent pas à la surproduction
Dans toute industrie sans monopole, quand un fournisseur fait défaut, un compétiteur capte sa clientèle. Pourquoi le marché du produit de santé fait-il exception à ce principe ? Les défaillances industrielles momentanées ne seraient-elles que des épiphénomènes ?
Ces tensions étant observables depuis maintenant plusieurs années, alors même que la croissance de la consommation mondiale ralentit légèrement, il est important de comprendre pourquoi les industriels ne sont pas encouragés à accroître leurs volumes pour certaines molécules, ni à se doter de nouvelles lignes de production.
Une polarisation grandissante de l’offre entre produits innovants et génériques
Une partie de l’explication se trouve dans la transformation du marché du médicament qui s’opère depuis plus d’une dizaine d’années. Le marché mondial de la biothérapie connaît en effet une croissance significative, environ deux fois plus rapide que celle du marché pharmaceutique global en 2025 (Barloutaud, 2020). Affichant une haute rentabilité, ces produits ne cessent d’attirer les plus grands groupes pharmaceutiques, qui ont ajusté leur modèle économique en conséquence. Le développement de biothérapies est en effet plus intensif en capital que celui de molécules chimiques. Pour rester compétitifs, les laboratoires s’appuient, entre autres, sur des partenaires spécialisés tels que les CRO (Contract Research Organizations ) et ont recours à l’acquisition de start-up de biotechnologie. Cette stratégie leur permet de reprendre des travaux de R&D existants et d’accélérer la mise sur le marché des produits à forte valeur ajoutée (Bernauer et al ., 2024). Ainsi, en 2021 en France, vingt ans après les premières impulsions du régulateur en faveur des génériques30, les laboratoires commercialisant des produits originaux brevetés (princeps ) affichaient toujours une marge plus de deux fois supérieure à celle des génériqueurs31.
Pour financer le développement coûteux de produits innovants, de nombreux laboratoires pharmaceutiques ont donc cédé leurs branches les moins rentables, souvent celles qui pilotaient des produits n’étant plus sous brevet (Agarwal et Handschuh, 2022), pour devenir des pure players . Novartis s’est ainsi séparé de Sandoz et Sanofi d’Opella et EuroAPI. Le marché s’est progressivement organisé autour de deux modèles économiques distincts : les produits innovants, intensifs en capital et à forte valeur ajoutée d’une part, et les génériques, généralement à plus faible valeur ajoutée d’autre part.
Cette spécialisation grandissante a mis fin à la péréquation financière qui existait au sein des groupes entre produits innovants et produits à maturité. Plus précisément, là où la haute rentabilité des produits innovants soutenait les investissements dans la fabrication des médicaments anciens – et donc la résilience des chaînes de production et d’approvisionnement – ces derniers sont de plus en plus produits par des génériqueurs spécialisés, affichant des marges
et des capacités d’investissement très faibles.
Comparaisons internationales
Le diagnostic porté dans ce rapport sur les pénuries de produits de santé en France repose à la fois sur des éléments nationaux et sur l’observation de dynamiques internationales, plus structurelles. Cela s’explique par le fait que les pénuries ne sont pas une exception française : l’ensemble des pays européens, les États-Unis et le Canada, pour ne citer qu’eux, y sont également confrontés.
Les comparaisons entre pays sont toutefois délicates, dans la mesure où les définitions de « rupture » ou « pénurie » ne recouvrent pas les mêmes éléments d’un pays à un autre. De même, tous les pays n’ont pas instauré d’obligation de déclaration des ruptures ou risques de rupture.
En se concentrant sur les médicaments, certains constats peuvent cependant être établis.
1. Les médicaments anciens (ou « matures ») et les génériques sont les plus touchés par les pénuries, que ce soit en Europe ou outre-Atlantique. En 2019, en Europe, moins de 10 % des pénuries de médicaments signalées concernaient des produits encore sous brevet*. De même, aux États-Unis, entre 2018 et 2023, environ deux tiers des pénuries déclarées concernaient des médicaments génériques (Daniel McGeeney et al ., 2025).
2. Avant la pandémie de Covid-19, les pénuries ne touchaient pas autant tous les pays. Selon la société spécialisée dans les données en santé IQVIA*, les données disponibles en 2019 permettent de dresser un tableau contrasté des pénuries de médicaments en Europe. Certains pays étaient alors bien plus touchés que d’autres. De même, très peu de pénuries semblaient alors être « globales » et toucher plus de cinq pays en même temps.
3. L’aggravation des pénuries post-Covid est perçue par les pharmaciens d’officine de la majorité des pays européens. Plusieurs éléments et exemples emblématiques tendent à signaler un changement d’environnement au lendemain de la pandémie. Un sondage annuel réalisé auprès de pharmaciens d’officine dans plus de 30 pays européens révèle une aggravation des ruptures d’approvisionnement dans de nombreux pays en 2022 et 2023 – avant une stabilisation en 2024 (PGEU, 2022 ; 2023 ; 2024 ; 2025)**.
4. Il existe maintenant des cas emblématiques de pénuries paneuropéennes post-Covid. Plusieurs pénuries majeures – telles que l’amoxicilline ou la quétiapine – sont illustratives de ruptures paneuropéennes, depuis la crise du Covid-19 (Martuscelli, 2024).
Faute de données plus complètes, ces exemples permettent au moins de prendre du recul par rapport à certains diagnostics hâtifs, qui imputent exclusivement les pénuries au prix de vente des médicaments en France. Selon certains acteurs interrogés, les prix français, inférieurs à ceux pratiqués ailleurs en Europe et dans le monde, expliqueraient que la France soit approvisionnée après les autres pays européens. Les entretiens menés auprès d’industriels et d’administrations n’ont toutefois pas permis de confirmer si de telles pratiques étaient massivement à l’œuvre. Bien que la rentabilité des produits de santé soit un des paramètres à prendre en compte pour comprendre la survenue de ruptures, les pénuries paneuropéennes mentionnées ci-dessus mettent également en évidence des dynamiques structurelles qui dépassent le cadre national.
(*) : Reporting of Medicine Shortages in Europe, IQVIA, 2020.
(**) : Un sondage similaire, réalisé auprès de pharmaciens hospitaliers européens, semble par ailleurs indiquer que la situation est restée stable, à un niveau critique, pour les hôpitaux entre 2019 et 2023 (Miljkovic’ et al ., 2025). Ces résultats restent cohérents avec les entretiens menés auprès de professionnels de santé dans le cadre de ce travail : en France, le circuit hospitalier, notamment en raison de sa taille et de son circuit d’approvisionnement spécifique, est relativement plus protégé en première ligne face aux pénuries.
En France – comme dans d’autres pays européens –, ce phénomène est amplifié du fait de l’administration des prix32. D’une part, la baisse du prix administré et l’ouverture à la concurrence qui surviennent lors de la perte du brevet n’incitent pas les laboratoires princeps à investir massivement dans la production de leurs produits plus anciens. D’autre part, le prix étant fixé pour chaque produit, qu’il soit en tension ou porté par une offre abondante, l’industriel n’est pas particulièrement encouragé à garder opérationnelles des capacités de production qui ne serviraient qu’en cas de tension sévère : aucune entreprise n’a intérêt à être le « fournisseur de secours » d’un acheteur, maintenant des capacités disponibles sans visibilité sur les ventes. A contrario , dans un régime de prix fixe, il est économiquement plus judicieux pour chacun d’utiliser ses capacités de production à 100 %.
La clause de sauvegarde : un dispositif imprévisible
La clause de sauvegarde, dont le principe est décrit en chapitre 1, est souvent critiquée par les industriels qui y voient un impôt supplémentaire nuisant à l’attractivité de la France (Pangrazzi, 2025). Elle représente en effet une contribution demandée aux industriels ; c’est un choix politique et budgétaire qui n’a pas vocation à être débattu dans le cadre de ce travail. La clause de sauvegarde peut néanmoins être analysée dans le cadre des pénuries sous deux angles.
D’une part, bien que le montant global de la clause de sauvegarde soit connu et estimé au moment du vote de la loi de financement pour la sécurité sociale (LFSS), la contribution individuelle de chaque acteur est, quant à elle, difficile à estimer a priori. Or, les investissements industriels et notamment la mise en place de nouvelles capacités de production nécessitent de la visibilité.
D’autre part, la clause de sauvegarde pose la question de l’équilibre souhaité entre le soutien à l’innovation (aux produits innovants) et celui apporté aux molécules plus anciennes. En effet, jusqu’en 2019, la clause de sauvegarde ne concernait que les médicaments sous brevet. Les médicaments génériques ont, entre-temps, été intégrés. Or, la croissance du chiffre d’affaires des génériques étant plus faible que celle des produits innovants, les génériqueurs ont critiqué le montant de la contribution qui leur était demandée*.
Face à cela, les LFSS 2023 et 2024 ont prévu deux ajustements importants, pour limiter les contributions redevables par les génériqueurs. Primo , la progression du chiffre d’affaires de l’entreprise est désormais prise en compte dans le calcul de la redevance individuelle – et non plus seulement le chiffre d’affaires absolu. Secundo , un seuil maximal de prélèvement a été mis en place pour les génériques, à hauteur de 1,75 % du chiffre d’affaires hors taxes en 2025 – contre 10 % pour les autres spécialités**.
(*) Le Gemme a d’ailleurs appelé dans un communiqué du 26 septembre 2024 à « une application différenciée et pérenne de la clause de sauvegarde pour un modèle prévisible et soutenable des médicaments génériques, hybrides et biosimilaires ».
(**) Source : Loi n° 2025-199 du 28 février 2025 de financement de la sécurité sociale pour 2025.
Des tensions éphémères au regard des contraintes industrielles
Le caractère momentané des pénuries est un autre élément qui n’incite pas les industriels à surproduire ni à garder disponibles des capacités de production qui ne seraient pas utilisées tout le temps.
En effet, les pénuries durent en moyenne six mois tandis que, selon les experts rencontrés dans le cadre de ce travail, la mise en place d’une nouvelle ligne de production demande douze à dix-huit mois dans le meilleur des cas33 . D’un point de vue strictement économique, il n’est donc pas rentable pour un industriel de développer une nouvelle ligne sitôt qu’une pénurie se déclare.
Ce délai nécessaire découle des contraintes réglementaires propres à l’industrie pharmaceutique, particulièrement réglementée. La qualité des produits représentant un enjeu sanitaire majeur, les industriels doivent suivre les good manufacturing practices (bonnes pratiques de fabrication), garantissant que la fabrication des médicaments se fait dans des conditions maîtrisées, sûres et reproductibles34 . Ils doivent également respecter les pharmacopées, c’est-à-dire les normes de qualité et les méthodes analytiques permettant de vérifier la conformité des produits de santé35 .
Outre les délais et défis industriels associés à ces exigences réglementaires, celles-ci peuvent être coûteuses pour les laboratoires. Un exemple concret de l’effet de ces normes porte sur la sérialisation des boîtes de médicaments en Europe. Reposant sur un dispositif d’inviolabilité apposé à chaque boîte, et sur l’identification de cette dernière par un code unique, la sérialisation renforce la sécurité de la chaîne de distribution des médicaments et permet de lutter contre les contrefaçons. Mais cela présente aussi un coût pour les laboratoires. Karine Pinon, présidente de l’Amlis, association représentant les PME de santé en France, était interrogée à ce sujet par la commission d’enquête du Sénat sur les pénuries de médicaments36 . Elle a répondu que la sérialisation des boîtes de médicaments coûterait en moyenne vingt centimes par boîte, sans que l’introduction de cette norme en 2019 n’ait mené à une revalorisation générale des prix des médicaments. Cette somme peut, certes, paraître minime pour des produits à prix élevés. Mais, comme évoqué précédemment, les produits les plus touchés par les pénuries ont un PFHT inférieur à cinq euros : vingt centimes représentent alors au moins 4 % du prix de vente.
La demande en produits de santé, facteur aggravant dans un contexte de pénuries
Une pénurie étant caractérisée par un déséquilibre, parfois temporaire, entre offre et demande, il convient désormais de mieux appréhender comment la demande constitue un autre facteur explicatif des pénuries.
La demande en produits de santé correspond à la consommation induite par les prescriptions des médecins à laquelle s’ajoute la dispensation par les pharmaciens d’officine et des pharmacies à usage intérieur (PUI). Le bon usage des médicaments, c’est-à-dire à la bonne dose et dans la bonne indication, représente un levier important de réduction de la demande globale en médicaments, et plus particulièrement de modération des risques de rupture
et de tension.
La consommation de médicaments en France se distingue sur deux points. D’une part, les Français sont historiquement parmi les plus grands consommateurs de médicaments en Europe – la France était en première position à la fin des années 2000. D’autre part, elle se démarque de ses homologues européens par une baisse significative – de l’ordre de 10 % – de sa consommation de médicaments en officine entre 2009 et 2022 (Drees, 2023), ce qui vient naturellement relativiser la caractéristique précédente. Bien que cette baisse de consommation ait été temporairement accélérée par la pandémie de Covid-19, elle s’inscrit dans une tendance de plus long terme, comme l’illustre la Figure 3.2 . Ainsi, la consommation de médicaments en officine en 2022, bien inférieure à celle relevée en Allemagne, est arrivée à parité avec celle relevée au Royaume-Uni.
Figure 3.2 – Quantité de médicaments vendus en officine par habitant (2009-2022)
Source : Drees (2023).
Lecture : en 2022, en France, la consommation par habitant de médicaments en officine était en moyenne de 1 250 (en unité standard).
Note : l’unité standard correspond à la plus petite dose utilisée pour un traitement (comprimé, cuillerée, etc.).
Il est important de noter que cette évolution se produit dans un contexte de vieillissement de la population, ce qui accroît tendanciellement la consommation de médicaments37. Pour autant, médecins prescripteurs, pharmaciens dispensateurs et patients ont tous un rôle à jouer dans la lutte contre le mésusage des produits de santé, un problème qui a déjà affecté et pourrait encore affecter leur approvisionnement en France.
Les médecins sont dans la majorité des cas les prescripteurs en produits de santé, et près de 85 % des dépenses pharmaceutiques des patients concernent des médicaments sur ordonnance (Drees, 2023). Or, des études comparatives internationales soulignent que le taux de prescription des médecins en France est bien supérieur à celui de leurs pairs d’autres pays européens, notamment aux Pays-Bas et dans certains pays nordiques (Richard et al ., 2023). Ainsi, en France, selon les estimations disponibles, plus de 75 % des consultations chez un médecin généraliste conduisent à une prescription de médicaments, sans que ce chiffre élevé ne puisse être expliqué par des besoins médicaux spécifiques à la population française (ibid. ).
Le cas emblématique des antibiotiques
En 2023, la France se positionne comme le cinquième pays européen s’agissant de la consommation d’antibiotiques par habitant. Celle-ci est près de deux fois supérieure à celle de pays comme l’Autriche, l’Estonie et la Finlande, et dépasse de plus de 80 % celle de l’Allemagne38. Ce phénomène est d’autant plus marquant que les Allemands consomment en moyenne plus de médicaments que les Français ; il y a donc une surconsommation d’antibiotiques en France. Obligatoirement prescrits par des médecins, ils sont également consommés cinq fois plus fréquemment par les enfants en France qu’aux Pays-Bas (Taine et al ., 2021). Cette surconsommation française d’antibiotiques trouverait une de ses origines dans leur prescription pour des infections virales, bien qu’ils ne soient utiles que pour soigner des infections bactériennes. Selon la Caisse nationale d’assurance maladie (CNAM), deux fois trop d’antibiotiques seraient ainsi prescrits pour le traitement des angines.
Outre les problèmes qu’elle pose concernant l’antibiorésistance des patients et l’inflation de la dépense pharmaceutique39 , cette surconsommation française d’antibiotiques est aussi de nature à fragiliser l’équilibre entre l’offre et la demande. Les hivers 2022-2023 et 2023-2024 ont été marqués par une pénurie sévère d’amoxicilline, un antibiotique couramment utilisé. Si les causes industrielles et logistiques en sont connues, les prescriptions trop fréquentes et injustifiées de ce médicament ont aggravé le problème. Ces pénuries ont aussi permis de rappeler l’intérêt des tests rapides d’orientation diagnostique (TROD), qui déterminent rapidement si une infection est bactérienne ou virale.
En cas de suspicion d’infection bactérienne, le médecin a la possibilité de conditionner la délivrance d’antibiotiques à l’accomplissement d’un test. Une systématisation des tests TROD40 aurait pu soulager de manière significative les approvisionnements de cet antibiotique, notamment durant l’hiver 2023-2024.
L’ensemble des acteurs rencontrés dans le cadre de cette étude plébiscitent une utilisation plus systématique des TROD pour assurer une meilleure disponibilité des médicaments. Cependant, les obligations de recertification à horizon 2027 du diagnostic in vitro pourraient mettre en cause la disponibilité de ces tests à moyen terme : alors que leur taux d’autocertification avoisine les 80 %, l’obligation de remarquage par l’un des rares organismes notifiés risque d’engendrer une longue file d’attente, et in fine une vague d’indisponibilités, affirme le syndicat de l’industrie du diagnostic in vitro (SIDIV) sur son site Internet41.
La rémunération sur objectif de santé publique et les enjeux de sur-prescription
Différentes études, souvent fondées sur des entretiens avec des médecins et patients, ont cherché à identifier des facteurs influençant le taux de prescription des médecins.
Une étude réalisée par la Drees en 2022 révèle ainsi que près de huit médecins généralistes libéraux sur dix rencontrent des difficultés à refuser une ordonnance d’antibiotiques à un patient qui en fait la demande (Verger et al ., 2022b). Dans le cadre de cette étude, les médecins ont également été interrogés sur la rémunération sur objectif de santé publique (ROSP). Il s’agit d’une rémunération basée sur la performance, elle-même caractérisée par différents indicateurs (développement du numérique en santé, amélioration de l’accès aux soins, ou encore bon usage des produits de santé). Introduit en 2011 par l’Assurance maladie, ce dispositif incite à une évolution des pratiques des professionnels de santé, de sorte à atteindre des objectifs de santé publique nationaux. Selon différents travaux, notamment de la Drees (2024a), la ROSP ne dépasse pas (ou rarement) 10 % de la rémunération des médecins.
Près de 70 % des médecins interrogés dans le cadre de l’étude de la Drees ont déclaré avoir atteint l’objectif fixé par la ROSP concernant la prescription d’antibiotiques. Cette affirmation contraste cependant avec les observations relatives à la surprescription de ces mêmes antibiotiques en France : cela peut signifier que l’indicateur en question n’est pas adéquat ou pas suffisamment ambitieux.
Depuis, un décret paru en octobre 2024* impose aux médecins de justifier davantage certaines prescriptions. En parallèle, entretiens et études révèlent également que le développement de prescriptions non médicamenteuses (régime diététique, activité physique…) est plutôt plébiscité par les médecins, mais que cela leur requiert d’accorder davantage de temps à chaque patient, ce qui a des implications majeures sur l’organisation et le modèle économique des consultations médicales (HAS, 2011). En effet, la tarification à l’acte, telle qu’elle existe en 2025, n’incite pas les médecins à mener des consultations plus longues.
Enfin, comme les médecins, selon une enquête menée en 2025 par l’Assurance maladie (2025), les patients ne se déclarent pas attachés à tout prix à l’obtention d’un traitement médicamenteux à l’issue d’une consultation médicale. La grande majorité des patients est en réalité satisfaite de ne pas recevoir de prescription médicamenteuse de la part de leur médecin, à condition que ce dernier prenne le temps nécessaire de leur expliquer pourquoi.
(*) : Décret n° 2024-968 du 30 octobre 2024 relatif au document destiné à renforcer la pertinence des prescriptions médicales.
Une demande en forte croissance et détournée de son indication première : le cas de l’Ozempic©
D’autres médicaments, plus récents et plus coûteux, connaissent des épisodes de pénurie à cause d’un excès de demande et d’un mésusage du produit. L’Ozempic© en est un exemple emblématique. Rappelons qu’il s’agit d’un produit innovant, dont le tarif en officine en France est supérieur à 75 euros42. L’Ozempic© fait partie de la famille des aGLP-1, une classe de produits qui contrôlent la glycémie en se fixant sur les récepteurs de l’hormone GLP-1, régulant ainsi le taux de glucose sanguin ainsi que l’appétit. Ces médicaments sont indiqués dans certains cas de diabète de type 2 ainsi qu’en cas d’obésité. L’Ozempic©, commercialisé par le laboratoire danois Novo Nordisk, a été autorisé sur le marché américain fin 2017, et sur le marché européen début 2018, pour le traitement du diabète de type 2 uniquement.
Jugé efficace pour perdre du poids, l’Ozempic© a commencé à être massivement détourné de son usage43 . De nombreux « patients » l’ont acheté et consommé pour maigrir. Des études menées au Danemark et aux États-Unis ont ainsi révélé que la part des personnes non diabétiques consommant de l’Ozempic© pour perdre du poids a significativement augmenté entre 2017-2018 (date d’entrée sur le marché) et 2022-2023 (Mailhac et al ., 2024). En France, le taux de mésusage estimé par les autorités compétentes était de l’ordre de 1,5 % en 2023, indique l’ANSM sur son site Internet. Les données danoises sont particulièrement intéressantes pour comprendre les mécanismes de report de la demande : en effet, la part des patients non diabétiques consommant de l’Ozempic© pour perdre du poids a atteint son maximum en 2022, avant de régresser en 2023, au moment de la mise sur le marché d’un autre aGLP-1, Wegovy©, autorisé sur le marché pour la perte de poids.
Figure 3.3 – Proportion de nouveaux patients danois non-diabétiques sous Ozempic©
Source : Mailhac et al., (2024)
Lecture : en 2022, plus de 30 % des nouveaux patients danois sous Ozempic© n’étaient pas diabétiques
La raison principale des ruptures d’approvisionnement et de stock d’Ozempic©, en France, en Europe et aux États-Unis, est bien sa consommation massive hors indication. A contrario , il ne s’agit pas d’un motif économique, ce médicament étant innovant et vendu à prix élevé. D’ailleurs, malgré la rentabilité des aGLP-1 (les ventes de Novo Nordisk ont augmenté de 25 % en 2024), la firme danoise n’a pas été en mesure de suivre l’évolution de la demande mondiale en Ozempic© et Wegovy©, puisque le développement de capacités de production n’est pas immédiat.
Cette pénurie a eu des effets préjudiciables sur les patients : elle a ralenti l’accès à l’Ozempic© pour certains sujets diabétiques. En France, l’ANSM a ainsi temporairement recommandé aux médecins de ne plus commencer de nouveaux traitements par aGLP-1 pour les patients diabétiques, le temps que les tensions d’approvisionnement se résorbent44.
Controverse sur les achats hospitaliers
Le milieu hospitalier, rappelons-le, conditionne près de 60 % de la consommation de produits de santé. Certains dispositifs médicaux sont même exclusivement utilisés à l’hôpital (produits pour les chirurgies, etc.). Or, selon plusieurs acteurs consultés, le système d’achat par les hôpitaux serait de nature à affecter l’approvisionnement en produits de santé.
Comme expliqué plus haut, les coopératives d’achats (UniHA, RESAH) lancent des appels d’offres et sélectionnent ainsi, pour chaque produit de santé, un ou deux fournisseurs avec lesquels ils passent des contrats, en volume et en prix. Ce recours à des coopératives, reflet de la professionnalisation et de la massification des achats hospitaliers, a été organisé avec l’appui de la Direction générale de l’offre de soins (DGOS), dans le cadre du programme Performance hospitalière pour des achats responsables (PHARE)45.
Toutefois, comme l’illustre notamment la commission d’enquête sénatoriale sur les pénuries de médicaments (de La Provôté et Cohen, 2023), certains acheteurs hospitaliers et praticiens sont critiques à l’égard de ces initiatives. Selon eux, la massification des achats, bien qu’elle permette des économies sur le papier, peut conduire à une concentration de certains marchés et à l’éviction de certains acteurs. Lorsqu’un industriel n’est pas retenu à l’issue d’un appel d’offres important, il risque de ne pas pouvoir maintenir sa ligne de production puisqu’il sait qu’il n’aura pas de commandes hospitalières pendant plusieurs années. Il aura plutôt intérêt à diminuer ses capacités de production, voire à les supprimer et à se reporter sur d’autres produits. Ainsi, selon ses détracteurs, le recours massif aux appels d’offres hospitaliers aurait fragilisé voire évincé des industriels français. Ce phénomène aurait notamment touché des TPE et PME46, moins résilientes que des grandes entreprises et qui ont par ailleurs plus de mal à répondre à des appels d’offres importants (Snitem, 2024b). Pour les hôpitaux, à long terme, le nombre d’alternatives en cas de défaillance d’un fournisseur s’en trouve réduit et l’exposition au risque de pénurie accru d’autant.
Ce raisonnement est toutefois controversé. Il répond tout à fait aux principes de l’économie industrielle, mais certains experts et industriels, en profond désaccord avec cette analyse, font valoir que le marché français n’est pas assez grand pour affecter de la sorte l’industrie pharmaceutique européenne ou mondiale (ibid. ). À ce jour, aucune étude chiffrée ne semble avoir été réalisée sur ce sujet pour confirmer ou infirmer le lien entre les appels d’offres hospitaliers et les pénuries de produits de santé en France.
- 26 – Source : ANSM.
- 27 – La chambre régionale des comptes du Centre-Val de Loire cite notamment l’hôpital d’Orléans dans un rapport (2017) : « Le CHRO n’exclut pas un risque de cartellisation du marché, entre les mains de quelques fournisseurs et estime que les barrières à l’entrée pour les nouveaux fournisseurs, les PME et les entreprises locales, peuvent être réelles. La sécurité des approvisionnements peut être menacée de par un rationnement volontaire du marché destiné à soutenir la position de force des offreurs. La multiplication des structures collectives de commandes ne lui apparaît donc pas sans inconvénients. »
- 28 – Pénuries de médicaments : les labos font-ils la loi ?, France TV, Cash Investigation, 2025.
- 29 – Charte d’engagement des acteurs de la chaîne du médicament pour un accès équitable des patients aux médicaments, ANSM, 2023.
- 30 – Les brevets princeps ont commencé à tomber dans le domaine public aux alentours de 1980,marquant le début de la production de médicaments génériques. Mais c’est seulement à la fin des années 1990 que les pouvoirs publics français ont commencé à les promouvoir. Leur définition est entrée dans le Code de la santé publique en 1996 et, en 1999, les pharmaciens ont été autorisés à substituer un médicament princeps par son générique. À cette date, les génériques représentaient 3,4 % des boîtes de médicaments remboursables en France. Le seuil des 10 % a été franchi en 2003. Source : choisirmongroupement.com.
- 31 – 9,6 % d’EBE pour les laboratoires princeps contre 4,0 % pour les génériqueurs (toutes activités confondues). L’EBE des génériqueurs descend à 0,3 % si l’on ne considère que les médicaments génériques de ville remboursables (source : Smart Pharma Consulting, pour le Gemme, 2021).
- 32 – Par exemple, en Allemagne, au moment du lancement sur le marché d’un nouveau produit, l’industriel fixe librement le prix pour les six premiers mois. À partir du septième mois, le prix est négocié entre l’industriel et le GKV-Spitzenverband, équivalent allemand de l’Union nationale des caisses d’assurance maladie. C’est ainsi un mécanisme comparable à ce qui existe en France.
- 33 – Voir également l’entretien du FigaroVox du 16 juin 2023 avec l’économiste Frédéric Bizard, pour qui « la relocalisation de chaînes de production en France prendra 3 à 5 ans ».
- 34 – Voir par exemple pour les États-Unis et l’UE respectivement : Current Good Manufacturing Practice (CGMP) Regulations, FDA, 2025 ; Good manufacturing practice, Agence européenne du médicament, 2025.
- 35 – Voir par exemple pour l’Europe : Pharmacopée européenne, direction européenne de la qualité du médicament et soins de santé.
- 36 – Compte rendu de la semaine du 27 mars 2023.
- 37 – Source : data.gouv.fr, 2022 (mis à jour en 2024).
- 38 – Source : European Centre for Disease Prevention and Control.
- 39 – En 2015 en France, plus de 120 000 personnes ont été touchées par des infections à bactéries résistantes. D’autre part, selon l’ANSM, une rationalisation de la consommation en antibiotiques en France pourrait engendrer des économies allant de 70 à 440 millions d’euros par an.
- 40 – Les pharmaciens peuvent désormais réaliser des TROD sans ordonnance du médecin pour les cas d’angine et de cystite.
- 41 – Mise sur le marché et marquage CE des tests et systèmes de diagnostic in vitro, SIDIV.
- 42 – Ce prix correspond à un mois de traitement d’après le Vidal.
- 43 – Les autorités européennes et américaines ont notamment dû faire face à de la publicité sur les réseaux sociaux pour ces produits, à destination des personnes souhaitant perdre du poids. Ce canal de communication a contribué au mésusage des aGLP-1.
- 44 – Source : Fédération Française des Diabétiques, 2024.
- 45 – Le site du ministère de la Santé décrit le programme PHARE ainsi : « un programme de transformation sur les achats hospitaliers, dont l’objectif est d’aider les hôpitaux à réaliser des économies intelligentes tout en préservant la qualité des soins ».
- 46 – Les TPE et PME représentent plus de 90 % des entreprises de DM en France.
Mettre fin aux pénuries : un travail de fond
Les solutions mises en place pour faire face aux pénuries sont principalement palliatives et ne permettent pas encore d’endiguer un phénomène qui exige de revoir plus profondément la manière d’équilibrer offre et demande.
Pas de panacée aux pénuries
Depuis la pandémie de Covid-19 qui a exacerbé aux yeux du grand public le problème des pénuries de produits de santé, plusieurs initiatives ont été mises en œuvre pour tenter de l’endiguer. Si certaines d’entre elles sont pertinentes, d’autres relèvent malheureusement de la « fausse bonne idée ».
Les obligations de stock, des mesures palliatives non ciblées
À commencer par l’obligation, depuis 2021, de constituer un stock de sécurité de deux mois pour les fabricants de médicaments d’intérêt thérapeutique majeur (MITM47). Cette obligation est étendue à quatre mois si un produit a fait l’objet de ruptures ou de risques de ruptures de stock au cours des deux dernières années. Une telle politique de stock minimal permet de gérer des tensions temporaires, assurant une continuité des soins et la protection des patients les plus vulnérables, comme l’ont souligné plusieurs professionnels de santé interrogés dans le cadre de ce travail. Néanmoins, ces obligations de stock ne tiennent pas compte de la spécificité des produits (forme galénique, produit à conserver à basse température, etc.) ni de la nature des fournisseurs (petite entreprise, sous-traitant CDMO48 ou grand laboratoire pharmaceutique…). Or, une telle norme peut mettre à mal la viabilité économique des petites entreprises, notamment celles qui produisent des médicaments à faible rentabilité49.
A contrario, cette durée de deux ou quatre mois s’avère insuffisante pour régler véritablement le problème des ruptures d’approvisionnement qui, selon la Drees, durent en moyenne six mois. Il faudrait donc allonger la durée de cette obligation de stock ce qui, du point de vue des industriels, ne serait pas viable. Rappelons que les produits sont stockés dans leur boîte et avec un étiquetage destiné uniquement au marché français, ce qui ne permet pas un redéploiement des stocks efficace et rapide entre pays (de La Provôté et Cohen, 2023). De plus, en raison des mises à jour régulières des notices des médicaments, les industriels jugent inopportun d’allonger la durée des stocks obligatoires, car ils devraient alors distribuer en priorité les boîtes avec les anciennes notices. Nous voyons que cette piste conduit immanquablement à poser la question de la forme des stocks (boîtes commercialisables, stocks de gélules prêtes à être mises en boîtes, etc.) et de la mise en place de stocks de produits semi-finis, de sorte à gagner en agilité pour les mobiliser rapidement en cas de tension, au niveau national ou européen.
Enfin, nombre d’industriels, professionnels de santé et experts publics interrogés s’accordent sur une chose : les politiques de stock ne s’attaquent pas aux causes racines des pénuries et devraient être employées en complément de mesures alternatives et innovantes.
Les listes de médicaments critiques
En 2023, à l’initiative du ministère de l’Économie, une liste de médicaments « stratégiques sur les plans industriel et sanitaire » (MSIS) a été réalisée pour identifier les produits critiques vulnérables sur le plan industriel. Cette liste a été établie à partir de la liste des « médicaments essentiels »50, de façon à parvenir à un nombre restreint de médicaments et de disposer d’un outil réellement opérationnel. Pour ce faire, les médicaments essentiels ont été évalués d’un point de vue industriel, de manière à référencer les éventuelles vulnérabilités au sein de la chaîne de production. Les MSIS répondent ainsi aux exigences suivantes : leur chaîne de valeur est sensible aux approvisionnements hors Union européenne ; la production de ces médicaments est dépendante de producteurs d’API hors Union européenne ; des ruptures régulières de ces médicaments ont été signalées par le passé. Les 48 premiers MSIS ont été annoncés en mai 2023.
En s’appuyant sur cette liste, la Direction générale des entreprises (DGE) a lancé un appel à projets « Relocalisation de médicaments essentiels », dans le cadre du plan France 2030 (DGE, 2025). L’objectif affiché de ce programme est de « renforcer ou relocaliser des étapes clés de la production de médicaments essentiels en France ». Pour l’heure, 14 projets ont été soutenus à hauteur de 50 millions d’euros de financements publics.
En parallèle, une liste de « médicaments critiques » a également été élaborée au niveau européen51, lors de discussions entre les différents États membres. Initialement, près de 600 principes actifs ont été retenus sur la base des listes nationales de médicaments critiques de six États membres (la Finlande, la France, l’Allemagne, le Portugal, l’Espagne et la Suède). Cette liste a été complétée par l’EMA, puis rationalisée pour parvenir à un total de 200 médicaments critiques, en utilisant un critère de gravité de la pathologie adressée et de disponibilité d’alternatives thérapeutiques.
Figure 4.1 – Les différentes listes de médicaments critiques en France
Source : liste des médicaments essentiels, Direction générale de la santé, 2024.
La constitution de listes de produits critiques et leur surveillance accrue constituent des outils utiles pour les politiques publiques, mais elles ne sauraient être suffisantes pour endiguer le phénomène des pénuries. En effet, même si l’anticipation est un facteur clé pour limiter les impacts des pénuries sur les patients, l’efficacité de ces listes est compromise tant par leur longueur, jugée excessive par plusieurs experts interrogés, que par leur révision fréquente. Ainsi, la liste de médicaments essentiels comptait 450 références avant d’être allongée en juin 2024 pour ensuite compter environ 600 références52. Dans les deux cas, cela complique un suivi sur-mesure, produit par produit et le long de la chaîne d’approvisionnement, de la matière première au produit fini.
La multi-attribution, un levier important mais pas une solution miracle
Une autre solution souvent mise en exergue pour améliorer l’approvisionnement en produits de santé est de développer voire d’imposer la mise en place de marchés multi-attributaires. Autrement dit, il s’agit d’encourager les industriels et acheteurs hospitaliers à se fournir auprès de plusieurs fournisseurs pour chaque produit de santé.
Pour les industriels, la multi-attribution peut se traduire par le recours à différents fournisseurs d’API ou de matières premières. Cela permet à l’industriel d’être plus résilient en cas de défaillance d’un de ses fournisseurs. Or, comme évoqué plus haut, l’examen des plans de gestion de pénuries (PGP) par la commission d’enquête du Sénat en 2023 a révélé que les industriels déclarent souvent un seul fournisseur53 (quand ce n’est pas aucun).
Du côté des hôpitaux, des changements sont à l’œuvre en matière de politique d’achat : 80 % des marchés de médicaments de UniHA, premier acheteur public français dans le domaine de la santé, sont désormais multi-attributaires, a indiqué son président Walid Ben Brahim lors d’une audition au Sénat en mai 202554. Cette multi-attribution est géographique : autrement dit, UniHA négocie avec plusieurs fournisseurs puis chaque hôpital est associé à l’un des fournisseurs.
La multi-attribution se fait peu au niveau de chaque hôpital car cette approche serait très complexe à mettre en œuvre. S’assurer que chaque pharmacie à usage intérieur (PUI) dispose de deux fournisseurs différents pour chaque produit nécessiterait qu’elle suive deux commandes par référence. En matière logistique, cela demanderait en outre des espaces de stockage supplémentaires dans la mesure où il faudrait deux emplacements distincts, pour des raisons de sécurité sanitaire. Il serait également nécessaire de tracer, pour chaque patient, le produit dispensé ainsi que le fournisseur correspondant.
La multi-attribution, même géographique, présente d’autres limites. Comme l’illustre l’exemple déjà mentionné de la quétiapine, dont l’approvisionnement a souffert de la défaillance de l’usine Pharmathen, plusieurs présentations de marques différentes peuvent avoir un seul et même fournisseur. La multi-attribution du côté des acheteurs hospitaliers ne donne alors que l’illusion d’une plus grande résilience de la chaîne d’approvisionnement, puisqu’en cas de défaillance du fournisseur en question, l’ensemble des industriels risquent de faire défaut. De même, et comme évoqué précédemment, si un industriel a une position dominante sur un marché multi-attributaire, le deuxième fournisseur risque de ne pas être en mesure de faire face à la défaillance du premier. Prenons l’exemple d’un marché avec deux acteurs, ayant des parts de marché respectives de 60 % et 40 %. Si le premier fournisseur fait défaut, le second doit théoriquement multiplier sa production par 2,5 pour servir l’ensemble du marché, ce qui semble peu réaliste. C’est précisément ce qui s’est passé pour la pénurie de quétiapine en France : le sous-traitant défaillant, Pharmathen, distribuait 60 % du produit sur le territoire national (ANSM, 2025).
Enfin, pour certains produits, un seul fournisseur existe sur le marché, rendant la multi-attribution tout simplement impossible (de La Provôté et Cohen, 2023).
Des partenariats public-privé à la production publique en propre
Une dernière solution souvent mise en avant pour faire face aux pénuries de produits de santé consiste à développer des partenariats public-privé voire des capacités de production publiques (Héraud et Lehman, 2024 ; Thinkerview , 2023). En particulier, le développement de partenariats public-privé par l’Établissement pharmaceutique de l’AP-HP, l’AGEPS, fait partie intégrante de la feuille de route gouvernementale contre les pénuries de médicaments55. À ce titre, l’AGEPS est habilitée à sous-traiter la production pharmaceutique à des industriels et à produire en propre des médicaments. Il s’agit notamment de permettre l’élaboration de préparations hospitalières spéciales (PHS), des préparations réalisées en cas de rupture de stock ou d’arrêt de commercialisation d’un MITM, en s’appuyant conjointement sur des PUI et des industriels56. L’AGEPS pourrait également reprendre l’exploitation et la fabrication de certaines des molécules abandonnées par les industriels.
Ces dispositifs visent à assurer une production constante de médicaments critiques. En s’affranchissant partiellement des choix stratégiques des industriels et investisseurs privés, ils concourent à renforcer l’autonomie stratégique de la France, diminuant la dépendance aux approvisionnements internationaux. Par le passé, l’AGEPS a déjà tiré profit de ses prérogatives : par exemple, durant la crise du Covid-19, le façonnier Delpharm a produit des curares à sa demande (Robillard, 2023). On peut imaginer, dans le même esprit, que l’AGEPS viendrait consolider les approvisionnements nationaux pour les molécules et DM critiques les plus sujets aux pénuries.
Cela suppose toutefois de relever certains défis et présente plusieurs limites. D’une part, il convient une fois encore de porter l’analyse tout le long de la chaîne de production. L’autonomie stratégique et la résilience des approvisionnements n’ont que peu de signification si elles se limitent aux toutes dernières étapes de la chaîne de production comme le conditionnement. D’autre part, les enjeux organisationnels et industriels ne sont pas minces. Pour l’AGEPS, cela implique d’être capable de passer puis de gérer des contrats avec des industriels et des sous-traitants pour piloter sa production pharmaceutique. Pour produire à un coût compétitif, ou du moins non rédhibitoire, il faut par ailleurs des volumes suffisants. Des pistes peuvent être étudiées en proposant par exemple des produits à des hôpitaux hors AP-HP. Toutefois, même ainsi, le volume minimal de production risque de ne pas être atteint pour certains produits ; c’est d’ailleurs pour cette raison que l’Europe tout entière se fournit parfois auprès d’une même usine (voir l’exemple du principe actif de l’Erwinase®, chapitre 3.). Cet éventuel coût supplémentaire peut cependant être vu comme un investissement nécessaire pour garantir la résilience de certains approvisionnements : une étude produit par produit serait alors nécessaire.
Une production publique en propre, qui ne reposerait pas sur un partenariat direct avec le privé, induirait par ailleurs une concurrence accrue et des volumes de vente amoindris pour les industriels. Pour ceux qui fabriquent des produits anciens, et plus particulièrement pour ceux dont les ventes se font principalement en direction des hôpitaux, le risque d’éviction n’est pas négligeable.
Produire des médicaments essentiels avec les hôpitaux : le cas de Civica Rx aux États-Unis
Aux États-Unis, un exemple remarquable de partenariat entre hôpitaux et industriels a été mis en place en 2018. Civica Rx, une entreprise pharmaceutique à but non lucratif, a été fondée par des hôpitaux et pour les hôpitaux. Son objectif est de lutter contre les pénuries de médicaments, et en particulier des médicaments génériques et de certains médicaments coûteux comme les biosimilaires ou l’insuline, en passant des contrats directement avec des industriels ou, dans certains cas, en produisant en interne.
À la mi-2025, Civica Rx pilotait l’approvisionnement d’environ 70 médicaments, approvisionnant environ 1 400 hôpitaux sur le territoire américain. Civica Rx a également construit une usine de production pour des produits stériles injectables aux États-Unis.
Pour toutes ces raisons, il ne semble pas réaliste que l’AGEPS reprenne en main la production de plusieurs centaines de médicaments ou DM. L’intervention de l’AP-HP est porteuse d’espoir pour certaines pénuries les plus sévères, mais cela ne saurait ainsi endiguer l’ensemble des déclarations de rupture ou de risques de rupture observées chaque année.
Quelles voies pour rééquilibrer l’offre et la demande en produits de santé ?
Les solutions déployées jusqu’à aujourd’hui visent essentiellement à endiguer les pénuries temporaires en produits de santé, mais d’autres leviers pourraient être activés pour s’attaquer aux causes racines de ces crises d’approvisionnement.
Un préliminaire : estimer les coûts induits par les pénuries
Ces mesures, quelles qu’elles soient, devront néanmoins rester en adéquation économique avec le coût des pénuries, dont le montant reste à estimer. En effet, en dépit de la succession de rapports publics portant sur les pénuries de produits de santé, aucune étude à ce jour et à notre connaissance ne s’intéresse au coût agrégé de gestion des situations de rupture, tant pour la collectivité et le système de santé que pour les industriels.
Ce coût dépend naturellement du point de vue adopté : il n’est pas le même pour les patients privés d’accès à leur traitement ou pour les professionnels de santé et industriels qui doivent à la fois mettre en place des solutions palliatives et subir les conséquences des pénuries. Quoi qu’il en soit, une remise à plat des dépenses engagées pour la mitigation des situations de rupture (temps consacré par les différents acteurs, préparations magistrales, etc.) permettrait d’assainir le débat sur les coûts et les bénéfices des différentes mesures envisageables.
Plusieurs des propositions que nous formulons ci-après ou qui ont été exprimées dans des rapports précédents soulèvent la question suivante : « qui va payer ? ». Cette question, aussi légitime soit-elle, peut parfois conduire à balayer certaines propositions avant même que leur pertinence ne soit étudiée dans le détail. Notre hypothèse est qu’une meilleure estimation des coûts de gestion des pénuries légitimerait certains des investissements défendus ci-après. Nous l’envisageons comme un préliminaire à toute autre action corrective.
Du côté de l’offre, renforcer la redondance industrielle tout au long des chaînes de valeur
Diversifier les acteurs au sein de la chaîne de production permet de réduire le risque de défaillance industrielle ponctuelle qui pénalise tous les autres acteurs en aval, et in fine le patient.
Il nous apparaît souhaitable d’orienter la politique de l’offre en faveur d’un soutien actif envers des acteurs industriels qui entendent créer cette diversité. Néanmoins, la commission d’enquête menée par le Sénat sur les pénuries de médicaments (de La Provôté et Cohen, 2023) conclut que les chaînes de valeur sont assez « opaques » ou du moins méconnues, a fortiori pour les dispositifs médicaux. Ce manque d’informations accessibles ne permet donc pas au régulateur d’avoir une bonne appréciation du degré de redondance des chaînes de production et de la diversité des acteurs présents à chaque étape. Nous ne pourrons durablement renforcer la redondance des chaînes de valeur sans entretenir une bonne visibilité sur les acteurs industriels impliqués à tous les stades.
Au-delà des subventions directes aux filières, d’autres mécanismes peuvent être mobilisés pour soutenir la réindustrialisation européenne et renforcer ainsi ces redondances. Par exemple, pourrait être instauré, sous conditions, un taux minimal obligatoire de diversification des approvisionnements (c’est-à-dire de multisourcing ) à l’attention des exploitants. Cela pourrait être complété d’un soutien aux fabricants de matières premières et notamment d’API.
Si le législateur souhaite aller plus loin en matière de multisourcing , il serait envisageable d’imposer aux façonniers européens, ainsi qu’aux façonniers extra-européens commercialisant en Europe, un taux de sourcing en matières premières (pour les DM) ou en API et excipients (pour les médicaments) produits en Europe, quand ils existent. Cela porterait sur un panel ciblé de produits critiques pour la souveraineté sanitaire, avec autorisation de contrôle par une agence du médicament (ANSM ou EMA).
Le droit européen ainsi que les règles de l’Organisation mondiale du commerce (OMC) s’opposent aujourd’hui à la mise en place d’une telle mesure. Néanmoins, la position européenne tend à s’infléchir sur ce sujet ; en mars 2025, la Commission européenne a pour la première fois suggéré d’introduire dans le Critical Medicines Act un critère Buy European dans les achats publics, faisant de cette filière la première à mettre en œuvre une mesure explicitement protectionniste. « Pour les médicaments essentiels, les acheteurs devront inclure un ensemble plus large d’exigences dans leurs procédures de passation de marchés, telles que la diversification des sources d’approvisionnement en matières premières et le suivi des chaînes d’approvisionnement. En cas de forte dépendance à l’égard d’un seul pays ou d’un nombre limité de pays, ils devront également imposer des exigences en matière de marchés publics favorisant la production de médicaments essentiels dans l’UE. Cela sera également possible pour d’autres médicaments d’intérêt commun, lorsque cela se justifie », explique un communiqué de la Commission européenne (2025).
Quoi qu’il en soit, acheter européen, c’est accepter de payer le prix d’une meilleure redondance au sein d’une chaîne de valeur à la transparence elle-même accrue. Un calcul sommaire permet de s’assurer que ce surcoût resterait modéré. Le prix de l’API représente en effet autour de 10 % du prix du produit fini pour des médicaments anciens ; or, l’écart de compétitivité entre fournisseurs reste généralement en deçà de 40 % (Stategy&, 2021). Le surcoût de l’approvisionnement européen devrait donc rester inférieur à 4 % du prix final. Ce taux reste par ailleurs une limite supérieure : il est possible et même souhaitable de conserver des sources d’approvisionnement diversifiées, pour limiter l’exposition aux défaillances ponctuelles d’acteurs industriels, fussent-ils européens.
Une question subsiste toutefois : qui prendrait en charge ce surcoût ? Il pourrait s’agir des exploitants ou de subventions étatiques ; cela relève assurément d’un arbitrage politique.
La France et l’Europe disposent de plusieurs sites de production de principes actifs, dont certains ont été soutenus dans le cadre du plan France 2030 (ibid. ). Pour autant, même quand certains exploitants y recourent, ce qui renforce la redondance industrielle des chaînes d’approvisionnement et la souveraineté sanitaire de l’Europe, cela n’est pas valorisé auprès des patients. Un affichage plus clair sur les emballages de produits de santé pourrait souligner cette production européenne. Deux logos pourraient être envisagés : le premier si la part de principes actifs fabriqués en Europe dépasse un certain seuil, le second si l’assemblage du produit final a eu lieu sur le territoire européen. Pour une même spécialité, le marquage européen pourrait inciter patients et prescripteurs à recourir aux produits européens, s’ils existent. Plus ambitieuse, et sans doute porteuse d’effets plus importants, une harmonisation européenne des boîtes de médicaments serait assurément de nature à faciliter l’interopérabilité avec nos voisins européens en cas de rupture. Cette standardisation du conditionnement des produits de santé, plébiscitée par divers industriels rencontrés, supposerait également la création de notices en plusieurs langues et, le cas échéant, des comprimés en nombre identique d’un pays à l’autre.
La condition sine qua non au succès de tels dispositifs repose sur la prise en compte du temps des cycles industriels. Par le passé, l’échec de diverses politiques industrielles concernant des produits de santé a pu être imputable à la durée inadaptée des expérimentations. Par exemple, la rupture généralisée de certaines formes d’amoxicilline au cours de l’hiver 2022-2023 a conduit les pouvoirs publics à expérimenter une revalorisation temporaire de 10 % (Sagnes, 2023). Cette revalorisation, prévue d’octobre 2023 à avril 2024, était consentie en contrepartie de la constitution de stocks suffisants pour répondre à la demande de la population française (des stocks contrôlés par l’ANSM). Or, plusieurs entretiens menés auprès d’industriels montrent qu’il n’est pas réaliste d’attendre un accroissement drastique de la production en un délai si contraint : pour rappel, douze à dix-huit mois minimum sont nécessaires pour lancer une nouvelle ligne de production. Les politiques industrielles doivent donc s’inscrire dans la durée.
Cela ne signifie pas pour autant que la mise en place de ces politiques doive elle-même tarder. Rappelons par exemple que la liste des médicaments essentiels n’est pas parvenue à devenir un outil opérationnel de travail, en partie à cause des débats qu’ont suscités ses modalités de constitution (Brafman, 2023b). Nous pensons au contraire que toute politique de réindustrialisation visant à lutter contre les pénuries doit être agile, débuter par des preuves de concept sur certains médicaments seulement, sans chercher dès son lancement une couverture exhaustive de produits concernés.
Du côté de la demande, encourager l’approvisionnement local et la rationalisation
Réduire les pénuries de produits de santé exige également d’agir sur la demande en produits de santé. D’une part, pour accompagner le renforcement de la redondance et la relocalisation des capacités de production en Europe, il faudrait encourager un approvisionnement européen et durable des acheteurs hospitaliers. Dans cet objectif, il serait possible de renforcer certains critères environnementaux dans les appels d’offres hospitaliers. Cette mesure permettrait un approvisionnement plus respectueux de l’environnement57 (voir encadré). De manière plus ambitieuse, il serait possible d’instaurer une obligation pour les acheteurs hospitaliers de prévoir une part d’approvisionnement européen à chaque appel d’offres, dès lors qu’une alternative européenne existe, pour encourager l’usage d’API produits en UE. Une stratégie d’achat hospitalier, combinant sources européennes et extra-européennes à l’échelle de chaque produit, permettrait de réduire les émissions de gaz à effet de serre tout en renforçant la résilience des approvisionnements en produits de santé. Cela permettrait par ailleurs aux hôpitaux de respecter leurs obligations en matière de réduction des émissions de gaz à effet de serre, auxquelles ces établissements sont soumis dans le cadre de la loi Climat et résilience. L’impact financier de cette mesure sur le système de santé pourrait être ajusté en fonction de la proportion d’approvisionnement.
L’empreinte carbone des produits de santé
Selon une étude du Shift Project parue en janvier 2025, la fabrication du principe actif est l’étape la plus émettrice de gaz à effet de serre du cycle de vie du médicament, avec plus du tiers des émissions totales. L’ensemble des étapes de fabrication (API, excipients, emballages) en représente près des trois quarts et le transport près d’un cinquième. Il convient toutefois de nuancer ces données : l’étape de façonnage n’est pas prise en compte, non plus que les fonctions dites de support à la production (ressources humaines, services financiers, etc.). Intuitivement, à chimie identique et à procédé de production similaire, un médicament produit en France pour servir le marché européen sera moins émetteur que ses homologues produits en Asie : le transport sera moins émetteur (car la distance parcourue sera moindre), tout comme la fabrication des composés (car le mix électrique français est moins émetteur que ses équivalents chinois ou indien).
D’autre part, pour répondre à des objectifs de santé publique et faire face aux tensions d’approvisionnement que la France connaît, il pourrait s’avérer judicieux d’encourager financièrement les médecins de ville à rationaliser leurs prescriptions médicamenteuses. Cela pourrait notamment se faire par un renforcement de la rémunération sur objectifs de santé publique (ROSP) des médecins, qui ne dépasse pas aujourd’hui 10 % de leur rémunération totale. De nouveaux indicateurs pourraient ainsi être ajoutés dans la ROSP. Cela pose toutefois des défis majeurs. Premièrement, pour une spécialité de médecine donnée, tous les professionnels de santé n’ont pas la même typologie de patients (enfants, personnes âgées, etc.). Certains indicateurs « globaux », par exemple la quantité d’antibiotiques prescrite par patient, seraient donc inappropriés voire trompeurs, dans la mesure où ils pénaliseraient les médecins dont les patients sont plus vulnérables. Les objectifs de rationalisation des prescriptions doivent ainsi tenir compte de la spécialité des médecins et de la typologie de leur patientèle. Deuxièmement, prescrire moins suppose de faire évoluer la culture de consommation de médicaments en France et de réétudier la relation des Français à leur médecin et aux médicaments (comme évoqué plus haut, la tarification à l’acte n’incite pas les médecins à mener des consultations plus longues ce qui, par exemple, rend plus difficile le renforcement de prescriptions non médicamenteuses). La baisse globale de la consommation de médicaments en France ces dernières années, et le fait que les patients français se disent prêts à consommer moins de médicaments, sont des signaux positifs laissant présager qu’une telle mesure est réaliste.
L’alignement de la rémunération des professionnels de santé avec un objectif de baisse de consommation de médicaments peut aussi s’appliquer aux pharmaciens d’officine. La structure de la rémunération de ces derniers a évolué ces dernières années, et est aujourd’hui moins indexée sur les ventes de médicaments remboursables. Il peut être opportun de poursuivre dans cette voie en renforçant le rôle de conseiller du pharmacien, dont l’expertise doit être mobilisée pour rationaliser la consommation de produits de santé lorsque cela est possible. C’est par exemple ce qui a été fait en 2024, quand a été donnée aux pharmaciens la possibilité de pratiquer sans ordonnance du médecin des tests d’orientation de diagnostic. Ce rôle de conseiller s’est également trouvé conforté avec l’extension de leur pouvoir de substitution, notamment dans le cas des biosimilaires. Dans le cas des médicaments biologiques, l’expertise du pharmacien est cruciale puisque la plupart de ces médicaments sont injectables ; il y a donc un enjeu de dispensation du traitement (dose unique ou ajustable, seringue, etc.). Il nous semble possible de rémunérer davantage les pharmaciens pour leur rôle de conseillers-experts et de diminuer dans le même temps leur rémunération indexée sur les ventes de médicaments remboursables, de sorte que leur rémunération globale ne soit pas affectée.
Enfin, nos observations mènent à conclure qu’une lecture globale et systémique des ruptures de produits de santé est nécessaire, avec un suivi dans le temps. Le renforcement du rôle du logiciel DP-Ruptures, dans le cadre de la LFSS 2025, permettra à cette plateforme de centraliser toutes les informations nécessaires issues des différents acteurs (industriels, grossistes répartiteurs, officines).
La nature exacte des informations intégrées dans cette nouvelle version du DP-Ruptures est encore à préciser : elles doivent notamment permettre de disposer d’une vision plus fine des stocks le long de la chaîne de dispensation58. L’accès aux données de DP-Ruptures est un enjeu critique, tant pour l’ANSM59 qui doit mener sa mission de régulation, que pour les patients. Pendant la crise du Covid-19, l’initiative ViteMaDose a permis aux patients de répertorier les lieux de vaccination à proximité. Sur ce même modèle, les patients pourraient, sous certaines conditions, accéder à des données issues de DP-Ruptures. Par exemple, grâce à une application que l’on appelle ici ViteMonMédoc, un patient se voyant prescrire un produit en tension d’approvisionnement pourrait avoir accès à la liste d’officines à proximité l’ayant en stock.
Une telle mesure suppose de s’assurer de la granularité de l’information partagée : les données de stocks étant concurrentielles, il faudrait limiter ViteMonMédoc aux produits en tension d’approvisionnement et prescrits par un médecin par exemple. N’oublions pas qu’un partage trop ouvert de l’information avec le grand public mène parfois à des mouvements de panique et donc à l’aggravation de certaines tensions, comme l’ont illustré les ruptures en papier toilette et en pâtes quelques jours à peine après la décision de confinement de la population pour faire face à la pandémie de Covid-19 (Le Monde , 2020). Une alternative serait que le pharmacien d’officine soit le seul à avoir accès aux données de stock de ses confrères. Ainsi, lorsqu’il ne dispose pas du produit de santé dans son officine, il serait contraint de consulter cette base de données et de rediriger le patient vers une pharmacie approvisionnée.
- 47 – Plus de 8 000 spécialités (marques de médicaments) sont des MITM sur un total de 13 000 spécialités.
- 48 – Pour Contract Development Manufacturing Organisations.
- 49 – Source : commission d’enquête du Sénat sur les pénuries de médicaments : compte rendu de la semaine du 27 mars 2023.
- 50 – Cette liste a été développée en 2023, avec l’appui de comités scientifiques. La méthodologie de cette initiative a fait l’objet de vifs débats (Brafman, 2023b) parce que seules certaines sociétés savantes et certains établissements ont été consultés. Plusieurs thérapeutes pointent du doigt la grande disparité entre aires thérapeutiques : certaines indications sont surreprésentées (comme le reflux gastro-œsophagien, avec cinq indications), alors que d’autres sont largement délaissées (traitement de la tuberculose, corticostéroïdes). À l’heure actuelle, et à notre connais- sance, cette liste n’a pas permis de prendre de mesures opérationnelles.
- 51 – Source : Union list of critical medicines, Agence européenne du médicament.
- 52 – Source : ministère du Travail, de la Santé, des Solidarités et des Familles, 2024.
- 53 – Les PGP, jugés trop peu flexibles par certains industriels rencontrés peuvent dans certains cas, ne pas être correctement renseignés. Toutefois, cela n’exclut pas la possibilité qu’il n’y ait qu’un seul fournisseur.
- 54 – Dans le cadre de la commission d’enquête sur la commande publique (compte rendu de la semaine du 12 mai 2025).
- 55 – Source : site Internet du gouvernement.
- 56 – Les PHS peuvent aussi être déclenchées en cas de risque de crise sanitaire important. Décret n° 2024-626 du 27 juin 2024 relatif aux préparations hospitalières spéciales. Légifrance.
- 57 La méthodologie de calcul pourra tirer profit des travaux de la DGE sur l’empreinte carbone des médicaments réalisés en 2025.
- 58 – Source : Loi n° 2025-199 du 28 février 2025 de financement de la sécurité sociale pour 2025.
- 59 – Avec ces nouvelles données, l’ANSM pourrait également s’assurer que la distribution de médicaments critiques se fait de manière équitable entre l’ensemble des officines du territoire
EN CONCLUSION
Les pénuries de produits de santé sont souvent causées directement par un manque de redondance dans la chaîne d’approvisionnement. Certains facteurs, comme les ventes directes ou certaines exigences réglementaires, peuvent par ailleurs affaiblir des chaînes d’approvisionnement déjà vulnérables.
Cependant, cette première analyse masque des causes plus profondes qui conduisent aux situations de rupture. Celles-ci sont caractérisées par un déséquilibre, parfois temporaire mais souvent plus durable, entre l’offre et la demande. Une analyse plus détaillée de ces deux aspects révèle les causes fondamentales des pénuries.
D’une part, les industriels ne sont pas incités à surproduire des produits de santé, notamment des produits anciens, dont le modèle économique présente moins d’attraits que celui des produits les plus innovants. Ainsi, il est nécessaire de renforcer les redondances dans les chaînes d’approvisionnement en médicaments à bas coûts, tout le long de la chaîne de valeur. Le débat doit également être éclairci par des études médico-économiques sur le coût de gestion des pénuries, qui permettront de mettre en lumière certains dysfonctionnements le long de la chaîne de valeur, et le cas échéant de justifier des mesures correctives.
D’autre part, la demande émanant des médecins, pharmaciens et patients est également un facteur explicatif des pénuries. La France demeure un pays grand consommateur de produits de santé par rapport aux autres pays européens, alors que les besoins médicaux de sa population sont globalement les mêmes. Face à l’augmentation des pénuries de produits de santé en France et en Europe, il est fondamental de rationaliser la demande. Le rôle des médecins est central pour assurer la pertinence des soins et des prescriptions. Pour renforcer l’offre en produits de santé européens, la demande – notamment celle émanant des hôpitaux – doit aussi évoluer et privilégier, lorsque cela est possible, l’industrie européenne.
La bibliographie
Agarwal, A., & Handschuh, T. (2022). The end of the Big Pharma Conglomerate, Oliver Wyman.
ANSM, (2025). Point de situation sur les tensions d’approvisionnement en quétiapine : une mobilisation au long cours pour couvrir au mieux les besoins des patients.
Assurance maladie (2025). Médicaments : moins consommer pour prendre soin de sa santé.
Audier, A., Biot, C., Collet, F., Epis de Fleurian A.-A, Leo, M. & Lignot-Leloup, M. (2023), Pour un « new deal » garantissant un accès égal et durable des patients à tous les produits de santé, [Rapport à la première ministre], mission régulation des produits de santé. Ministère de l’Économie.
Barloutaud, A. (2025). Un bel avenir pour les biothérapies, portées par l’innovation médicale, Les Echos investir, 7 août.
Baudet, G. & Dherbécourt, C. (2025). Tensions et ruptures de stock de médicaments déclarées par les industriels : quelle ampleur, quelles conséquences sur les ventes aux officines. Études et résultats de la Drees, mars.
Bernauer, M., et al. (2024). Life sciences M&A shows new signs of life, McKinsey & Company.
Biot, J. (2020), Mission stratégique visant à réduire les pénuries de médicaments essentiels, [Rapport au premier ministre].
Brafman, N. (2023a). Alerte sur l’Ozempic, un antidiabétique détourné pour perdre du poids, Le Monde, 2 mars.
Brafman, N. (2023b). Médicaments essentiels : la liste du gouvernement qui fâche les médecins, Le Monde, 25 juin.
Chambre régionale des comptes du Centre-Val de Loire (2017). Achats hospitaliers. Centre hospitalier régional d’Orléans, [Rapport d’observations définitives]. 4 avril.
CNOP (2025). PLFSS 2025 : le texte définitivement adopté au Parlement.
Commission européenne (2025). La Commission propose un acte législatif sur les médicaments critiques afin de renforcer l’approvisionnement en médicaments critiques dans l’UE. [Communiqué de presse du 11 mars 2025].
Cotterlaz, P., Gaulier, G., Sztulman, A., & Ünal, D. (2022). « Industrie pharmaceutique européenne : quand rentabilité rime avec vulnérabilité », La lettre du Cepii, N°423, janvier.
Daniel McGeeney, J., McAden, E., & Sertkaya, A. (2025). Analysis of Drug Shortages, 2018-2023. Data Brief. Eastern Research Group.
de La Provôté, S. & Cohen, L. (2023), Pénurie de médicaments : trouver d’urgence le bon remède, [Rapport de commission d’enquête du Sénat].
Delacroix, G. (2020). Coronavirus : en Inde, l’industrie du médicament sous haute tension, Le Monde, 11 avril.
DGE (2025). France 2030 : accélérer la relocalisation des médicaments essentiels, site de la direction générale des entreprises.
Drees (2022), Les dépenses de santé en 2021 – édition 2022.
Drees (2023), Les dépenses de santé en 2022 – édition 2023.
Drees (2024a). Les dépenses de santé en 2023 – Résultats des comptes de la santé – Édition 2024.
Drees (2024b). Tensions et ruptures de stock de médicaments déclarées par les industriels : quelle ampleur, quelles conséquences sur les ventes aux officines, Études & résultats.
France Assos Santé (2019). Pénurie de vaccins et de médicaments : les inquiétudes de France Assos Santé confirmées par une enquête exclusive. Résultats de l’enquête réalisée en décembre 2018 par l’Institut BVA auprès de 955 personnes.
France Assos Santé (2022). Pénuries de médicaments : dernière occasion d’agir pour le gouvernement [communiqué de presse].
France Assos Santé (2023). Baromètre 2023 des droits des personnes malades, Enquête réalisée en partenariat avec BVA Xsight.
France Assos Santé (2024). Pénuries de médicaments : la feuille de route 2024-2027 passée au crible.
France Info (2022). Trois questions sur la pénurie de Doliprane pour enfants, qui inquiète les pharmaciens et les parents. 6 décembre 2022.
Gers (2024). Analyse du profil des médicaments en pénurie.
HAS (2011). Développement de la prescription de thérapeutiques non médicamenteuses validées, [Rapport d’orientation], avril 2011.
Héraud, V. & Lehman, A. (2024). La création d’une capacité pharmaceutique publique permettrait de garantir une production stable de médicaments essentiels, Le Monde, 23 octobre.
Robillard, J. (2023), La fabrication de médicament en pharmacie hospitalière va se renforcer, Hospimedia, 25 septembre.
Leem (2011). Les entreprises du médicament en France. Éléments chiffrés.
Leem & Roland Berger (2014). Comment relancer la production pharmaceutique en France ?, [rapport].
Leem (2021). Tensions et risque de ruptures des médicaments. L’urgence de la sécurisation des approvisionnements. [Dossier de presse].
Leem (2022). Bilan économique, édition 2022.
Leem (2025). Bilan économique 2023-2024 des entreprises du médicament.
Le Monde (2012). Prothèses mammaires PIP : chronologie d’un scandale, 18 janvier.
Le Monde (2020). Coronavirus : dans le monde, la fièvre du stockage et une ruée sur le papier toilette, Billet de blog. 23 mars.
Mailhac, A., Pedersen, L., Pottegård, A., Søndergaard, J., Mogensen, T., Sørensen, H. T., & Thomsen, R. W. (2024). Semaglutide (Ozempic®) Use in Denmark 2018 Through 2023 User Trends and off-Label Prescribing for Weight Loss. Clinical epidemiology, 16, 307–318.
Martuscelli, C. (2023). Europe is running out of medicines. Politico, 29 janvier.
Millet, L. (2022). Souveraineté sanitaire en France : comment permettre une plus grande autonomie de notre système de santé ?, Institut Montaigne, 3 novembre 2022.
Miljković, N., Polidori, P., Leonardi Vinci, D., et al. Results of EAHP’s 2023 shortages survey. European Journal of Hospital Pharmacy 2025. 32:307-315.
Pangrazzi, C.(2025). Attractivité en berne : les laboratoires tournent le dos à la France, Le Moniteur des Pharmaciens, 18 juin.
PGEU (2022). PGEU Medicine Shortages Survey 2021 Results.
PGEU (2023). PGEU Survey 2022 Results.
PGEU (2024). PGEU Medicine Shortages Report 2023.
PGEU (2025). PGEU Medicine Shortages Report 2024.
Pulicani, M. (2025). Pénurie de médicaments : Vigirupture a les stocks à l’œil, Le Moniteur des pharmacies, 22 mars.
RAPS (2016). FDA Warns Teva’s Banned Hungary Manufacturing Facility.
Richard, A., Mariotti, B., Piñol-Domenech, N., Vorilhon, P., & Vaillant-Roussel, H. (2023) Prescription-free consultation in France and Europe: Rates’ evolution, physicians’ and patients’ perceptions from 2005 to 2019, a systematic review, Therapies, Volume 78, 2023.
Sagnes, H. (2023), Le prix de l’amoxicilline va augmenter de 10 %, Les Echos Etudes, 2023.
Sicos (2023), Étude sur la vulnérabilité amont et aval des molécules critiques et leviers d’actions. Février 2023.
Snitem (2023). Panorama des entreprises du dispositif médical en 2023, p. 17.
Snitem (2024a). Règlement européen sur les dm. Où en sommes-nous ?. Snitem Info. Dossier hiver 2024.
Snitem (2024b). Les entreprises du dispositif médical tirent la sonnette d’alarme sur les délais de paiement à l’hôpital [Communiqué de presse du 26 septembre 2024].
Strategy&, (2021). Étude des vulnérabilités d’approvisionnement en APIs pour l’industrie pharmaceutique européenne.
Taine, M., Offredo, L., Dray-Spira, R., Weill, A., Chalumeau, M., & Zureik, M. (2021). Paediatric outpatient prescriptions in France between 2010 and 2019: A nationwide population-based study. The Lancet Regional Health – Europe, Volume 7, 2021.
Tassain, F. (2023). Les pharmaciens autorisés à dispenser l’amoxicilline en préparation magistrale, Le Quotidien du pharmacien, 2 janvier.
The Shift Project, (2025). Décarbonons les industries du médicament.
Thinkerview (2023), Effondrement, pénurie de médicaments ? Interview de Clémence Marque, [Vidéo Youtube].
Verger, P. et al. (2022). Un médecin généraliste sur deux est confronté à des problèmes d’antibiorésistance, étude pour la Direction de la recherche, des études, de l’évaluation et des statistiques.
Vidal (2018). Rupture de stock d’Erwinase : mobilisation des stocks et dépannage avec des unités irlandaises. 15 octobre 2018.
Vizient (2025). Beyond the Shortage: The Hidden Cost of Drug Supply Chain Disruptions, juin.
Xerfi (2025). Le marché du façonnage pharmaceutique à l’horizon 2028. Quelles stratégies face aux enjeux de souveraineté et de décarbonation ? Xerfi.
Annexe I – Méthodologie
Cet ouvrage s’appuie sur les résultats d’une cinquantaine d’entretiens semi-directifs menés auprès de divers acteurs : industriels, professionnels de santé, membres des administrations et représentants de patients. Ces échanges ont permis de recueillir les témoignages d’experts du sujet ou de professionnels faisant face aux pénuries de produits de santé au quotidien. Les personnes rencontrées ont pu exprimer librement leur point de vue et partager leurs expériences.
Une lecture approfondie des rapports existants (Biot, 2020 ; de La Provôté et Cohen, 2023 ; Audier et al. , 2023) sur le sujet a également été effectuée. L’ensemble des références mobilisées est détaillé tout au long du rapport. Cette revue de littérature a fourni une base solide pour contextualiser les données recueillies lors des entretiens.
Enfin, des immersions sur le terrain ont été réalisées dans des hôpitaux, des officines et auprès d’industriels français du médicament. Ces observations directes ont offert une vision concrète des enjeux et des défis quotidiens, enrichissant l’analyse avec des données empiriques.
Annexe II – Liste des acteurs rencontrés
Annexe III – Liste des acronymes et sigles utilisés
Annexe IV – Systèmes d’information utilisés pour la gestion des pénuries
Annexe V – Récapitulatif des propositions des auteurs
Proposition 1 : Réaliser une étude médico-économique sur les coûts de gestion des situations de rupture, sur la base d’épisodes passés.
Porteur : organisme tiers.
Proposition 2 : Valoriser les productions de principes actifs et le façonnage made in Europe par un marquage sur les boîtes, pour sensibiliser le consommateur.
Proposition 3 : Harmoniser les boîtes de médicaments à l’échelle européenne.
Porteur : ANSM.
Proposition 4 : Imposer progressivement aux façonniers un quota d’approvisionnement en API et excipients européens, quand une offre est disponible.
Porteur : ANSM.
Proposition 5 : Continuer à développer des marchés multi-attributaires pour les acheteurs hospitaliers en tenant compte des limites de ces marchés tels qu’ils sont aujourd’hui.
Porteurs : DGOS, centrales d’achat.
Proposition 6 : Imposer une part d’approvisionnement européen aux acheteurs hospitaliers pour les produits de santé quand une alternative européenne est disponible.
Porteur : DGOS.
Proposition 7 : Réétudier le modèle de rémunération des pharmaciens d’officine et médecins en cohérence avec l’ambition de rationaliser la consommation de produits de santé.
Porteurs : CNOP/CNOM/Syndicats de professionnels/DGS/Assurance maladie.
Proposition 8 : Développer l’application ViteMonMédoc pour un accès aux données aux patients dans certains cas spécifiques (médicaments en tension et prescrits par un médecin, par exemple). Alternativement, développer le principe de ViteMonMédoc à destination des pharmaciens d’officine uniquement.
Porteurs : DINUM, CNOP.
Baptiste Poterszman et Hugo Pouzet,
Médicaments : d’où viennent les pénuries ?,
Les Docs de La Fabrique, Presses des Mines, 2026.
ISBN : 978-2-38542-774-0
ISSN : 2495-1706
© La Fabrique de l’industrie
81, boulevard Saint-Michel 75005 Paris
info@la-fabrique.fr
www.la-fabrique.fr